科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-26
来源:BioArt
造血干细胞(HSCs)靶向基因编辑是一种很有前景、很有潜力的、针对多种疾病的治疗方法。它能够通过靶向基因组编辑来实现突变等位基因的原位校正、功能恢复和生理表达控制【1】。可编程核酸酶(如CRISPR/Cas)通过将位点特异性DNA双链断裂(DSBs)引入基因组来进行基因编辑【2】。DSB修复可以通过高保真同源定向修复(HDR)来实现,利用外源DNA模板进行基因校正或靶向整合。然而,HDR在HSCs中的效率不佳以及该过程对克隆组成和移植动力学的未知影响阻碍了临床应用。
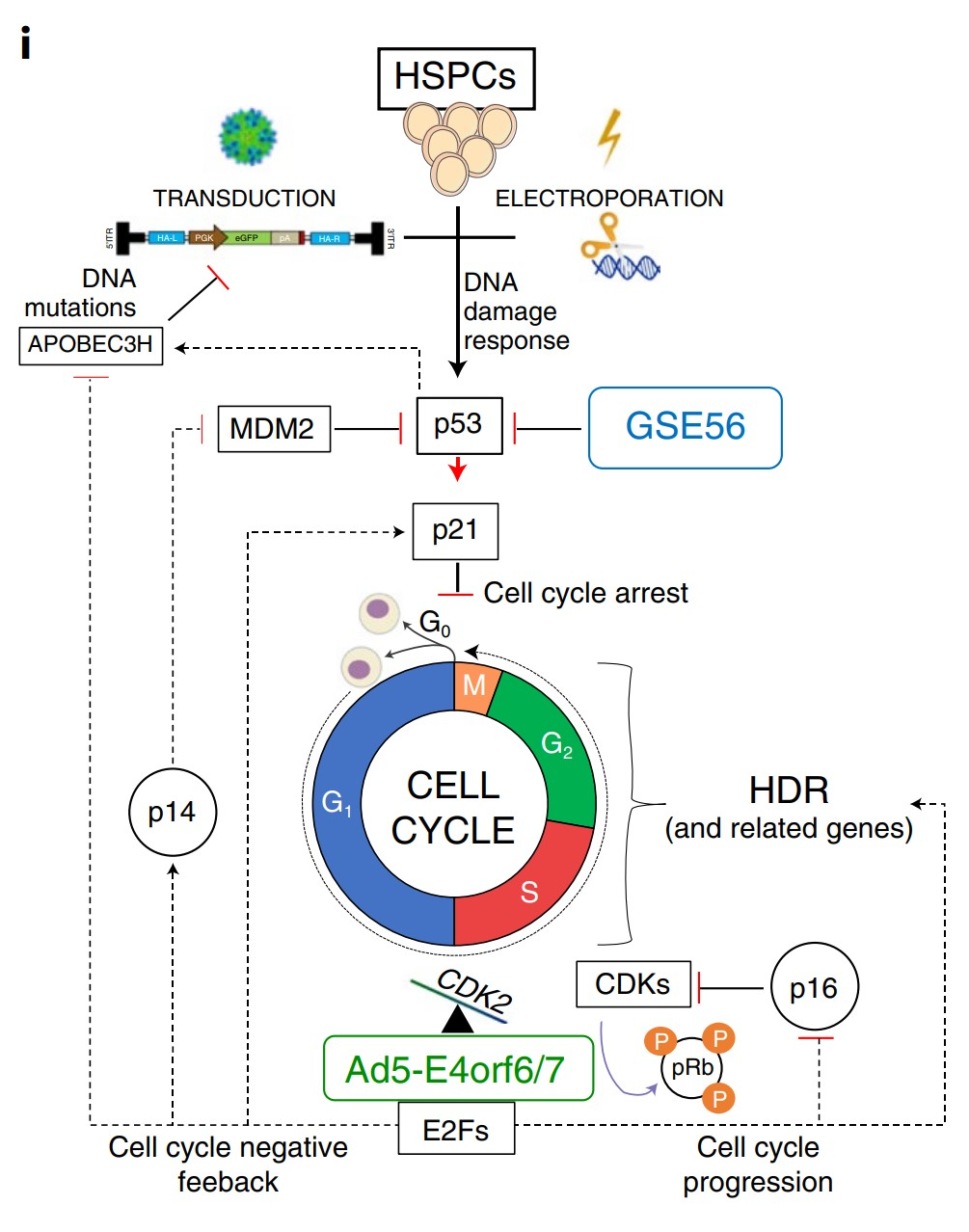 图1. Ad5-E4orf6/7通过E2F途径促进细胞周期进程并上调HDR机制示意图
图1. Ad5-E4orf6/7通过E2F途径促进细胞周期进程并上调HDR机制示意图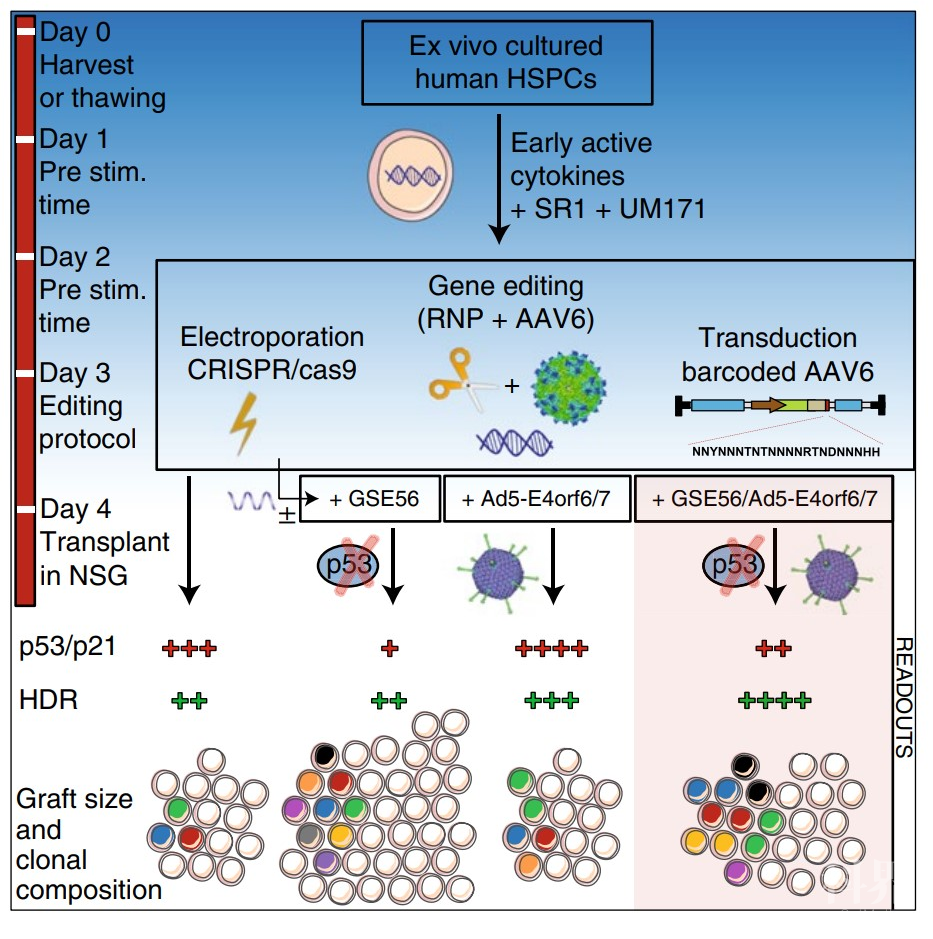 图2:HSPCs中的编辑策略及其结果示意图
图2:HSPCs中的编辑策略及其结果示意图来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652493071&idx=3&sn=b59766c555f19d94e69624451139f6d5&chksm=84e246bbb395cfadac8275ec39f622169d259c97458e11df110e1e1827cd3a43c19e7b8d09c5#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
编辑基因创造超人,霍金的担心是不是杞人忧天



基因工程,助力生命科学研究

材料基因工程在船舶领域的应用思路
Nature:颠覆性发现,肠道菌群将突变p53基因从促癌基因转变为抑癌基因
同样搞基因编辑,贺建奎 黄军就何以评价两极化



陈军/谈伟强合作揭示抑癌基因p53在中暑阈值高温下保护细胞存活

一年前,他就知道了贺建奎的疯狂计划

中国科学家培育出基因编辑瘦肉猪:脂肪少24%
科技日报四问“基因编辑婴儿”

精准基因工程技术