科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-30
来源:BioArt
靶向诱导蛋白降解技术(Proteolysis targeting chimeras, PROTAC)成为继小分子抑制剂(SMI)和单克隆抗体(mAb)药物后的又一大热门。与SMI和mAb相比,PROTAC具有独到的优势,能够靶向众多的以前被称为“不可成药”的蛋白分子。迄今已有上百种PROTAC分子已经或者正在研制当中,众多的新兴创业公司也是群雄崛起,包括国外的Arvinas(以Craig Crew为代表,其代表作为第一个进入临床试验的PROTAC分子ARV-110),C4(以Nathanael Gray和James Bradner为代表),Kymera,Vividion,Cedilla (创始人包括诺奖得主William Kaelin等),Oncopia(王少萌为代表),Cullgen(金坚为代表),而多家大药企也在跑马圈地,如诺华(James Bradner领导)、安进(Raymond Deshaies领导,详见BioArt报道:Nature | 第四次制药业革命-Raymond Deshaies院士独家综述多特异性药物)等。另外,国内也成立了多家以PROTAC为基础的初创企业,如凌科药业、分迪科技、开拓药业等。 虽然相对于SMI和mAb药物,PROTAC具有独特的优势,但是也存在明显的短板。比如,PROTAC的靶点通常是胞内蛋白,而对分泌蛋白和细胞膜蛋白则束手无策。细胞膜蛋白的降解通常是通过溶酶体途经完成,如EGF引起的EGFR降解过程。因此,溶酶体降解途经也成为靶向降解膜蛋白的主要设计思路。 2020年7月29日,斯坦福大学HHMI研究员Carolyn R. Bertozzi教授在Nature杂志上发表了题为Lysosome-targeting chimaeras for degradation of extracellular proteins的文章,在文中,作者设计并验证了使用溶酶体降解途经降解胞外蛋白和细胞膜蛋白的LYTAC技术,并以EGFR,PD-L1和CD71等为例证明了LYTAC技术的可行性和特异性。该研究成为PROTAC的外延,丰富了蛋白降解途经成药的工具箱。
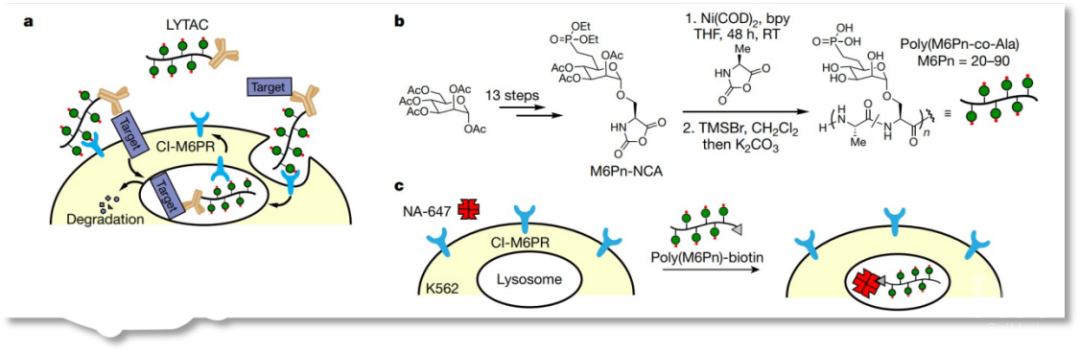 图1. LYTAC系统图示
图1. LYTAC系统图示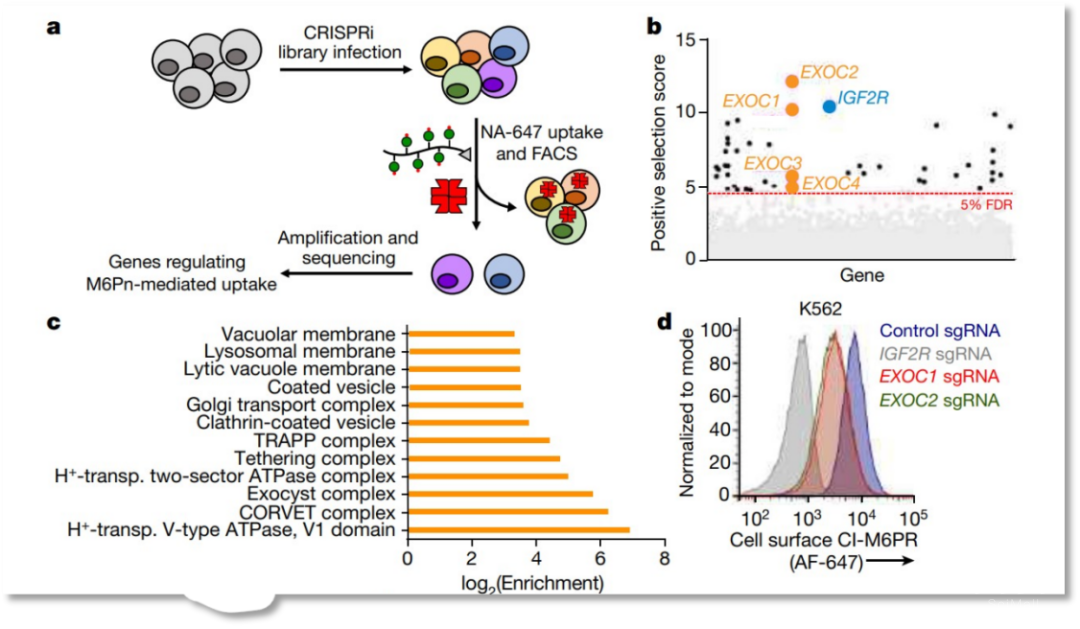 图2. CRISPRi筛选识别LYTACs的关键细胞机制
图2. CRISPRi筛选识别LYTACs的关键细胞机制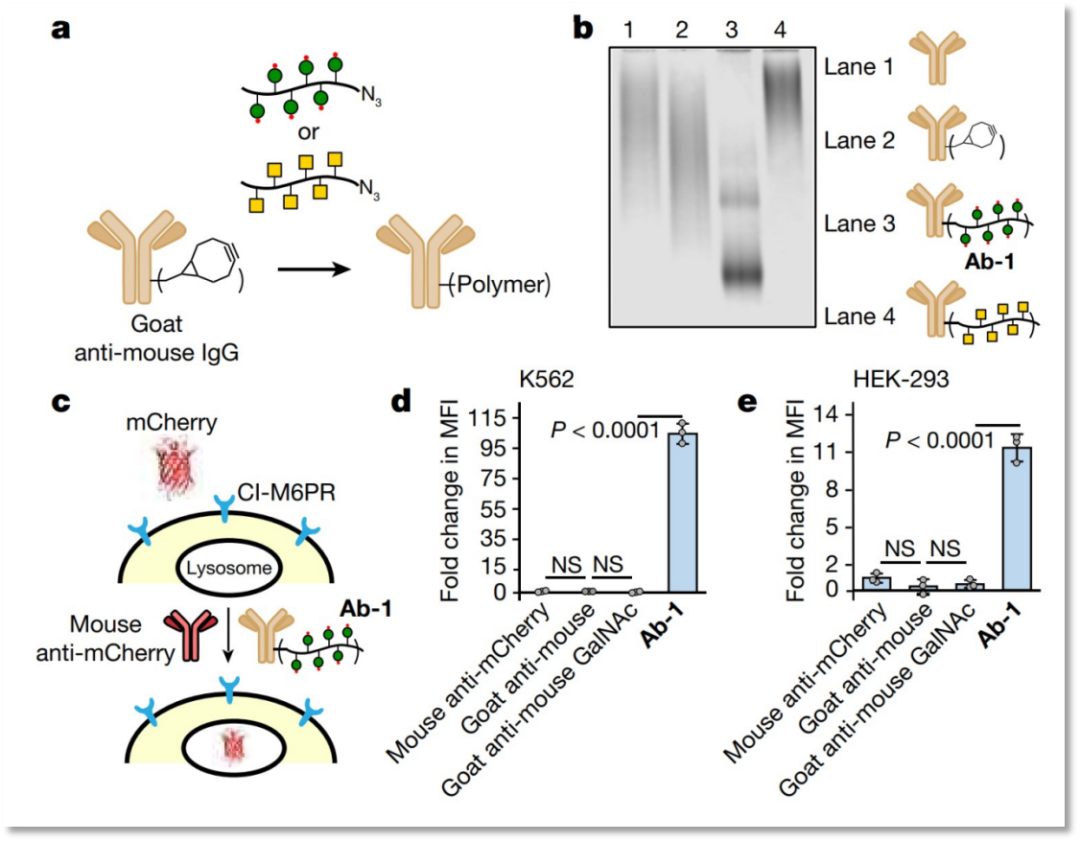 图3. LYTACs将可溶性蛋白质靶向溶酶体进行降解
图3. LYTACs将可溶性蛋白质靶向溶酶体进行降解来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652494046&idx=4&sn=441d439615792ca239f7c8e817800bd6&chksm=84e24b6ab395c27c3968e3ffc2f55861f12559ac9e0678b01dcf4b78d60e7a4375b6ba18a22a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
分泌溶酶体

评价细胞内组织蛋白酶活性和溶酶体pH的新标尺
埃博拉幸存者的抗体带来疫苗研发新途径 |《自然-结构和分子生物学》

Cell:小分子靶向溶酶体降解逆转蛋白质错误折叠相关疾病
丙型肝炎病毒抗体免疫球蛋白M

人体毛发为何如此分布?或许是因为一种特殊蛋白
抗热休克蛋白-60抗体
中和细菌细胞壁碎片可改善小鼠自身免疫 |《自然-微生物学》
抗角蛋白抗体(AKA)

Cell:小分子靶向溶酶体降解逆转蛋白质错误折叠相关疾病