来源:iNature
在这短短3天,中国学者在Nature ,Cell 及Science 共发表了7项重要的研究成果,iNature进行了系统盘点:无机半导体对于许多关键应用至关重要,但几乎都非常脆弱。2020年7月31日,上海交通大学及中国科学院上海硅酸盐研究所等多单位合作,陈立东,史迅及Jian He共同通讯在Science 在线发表题为“Exceptional plasticity in the bulk single-crystalline van der Waals semiconductor InSe”的研究论文,该研究报告了硒化铟(InSe)的超塑性变形性。块状单晶InSe可以在室温下压缩几个数量级,并变形成 Möbius带或简单的折纸。该研究建议使用组合形变指示器(Ξ)来预筛选候选体半导体,以用于下一代形变或柔性电子产品。2020年7月31日, 中国科学院西双版纳热带植物园星耀武及美国田野博物馆Richard H. Ree共同通讯在Science 在线发表题为“Exceptional plasticity in the bulk single-crystalline van der Waals semiconductor InSe”的研究论文,该研究发现在世界上温带-高寒高山上,西藏-喜马拉雅山-横断地区,生物群系的系统发育重建和地理范围演化表明,现存世系由早渐新世出现,并在横断山中首次出现。到中新世早期至中期,山地建设和亚洲季风加剧了邻近地区的多样化和殖民化。 横断山脉的高山湖泊比地球上任何其他高山植物区系持续存在的时间更长,这说明过去的地质和气候事件塑造了现代生物区系。2020年7月31日,中国军事医学科学院微生物流行病研究所孙世惠,周育森(已故), 秦成峰及复旦大学姜世勃等人在Science 在线发表题为“Adaptation of SARS-CoV-2 in BALB/c mice for testing vaccine efficac”的研究论文,该研究通过在年老的BALB / c小鼠的呼吸道中进行连续传代来适应SARS-CoV-2的临床分离株。在第6代产生的适应小鼠的品系(称为MASCp6)在小鼠肺中显示出增加的感染性,并在鼻内接种后在年幼和老年小鼠中引起间质性肺炎和炎症反应。 深度测序揭示了一组可能与毒力增加相关的适应性突变。特别地,N501Y突变位于刺突蛋白的受体结合结构域(RBD)。使用该模型验证了重组RBD疫苗候选物的保护功效。因此,这种小鼠适应株和相关的挑战模型应该在评估针对SARS-CoV-2的疫苗和抗病毒药物方面具有价值。
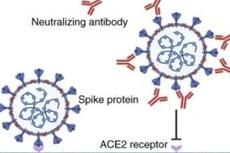
2020年7月31日,中国科学技术大学潘建伟及苑震生共同通讯在Science 在线发表题为"Cooling and entangling ultracold atoms in optical lattices"的研究论文,该研究在理论上提出并实验实现原子深度冷却新机制的基础上,在光晶格中首次实现了1250对原子高保真度纠缠态的同步制备,为基于超冷原子光晶格的规模化量子计算与模拟奠定了基础。2020年7月29日,中国科学院国家天文台商朝晖等人在Nature 在线发表题为“Night-time measurements of astronomical seeing at Dome A in Antarctica”的研究论文,该研究报告使用差分图像运动监视器在Domes A上夜间观看的测量结果。它位于仅8米的高度,记录的观测时间低至0.13弧秒,并提供了与Domes C处20米的高度可比的观测统计数据。相关性确定了从声波雷达发现的Domes A边界层的中值厚度约为14米。边界层较薄,因此将望远镜置于其上方的难度较小,从而可以更轻松地进入自由大气层。2020年7月29日,四川大学华西医院生物治疗国家重点实验室魏霞蔚,逯光文和澳门科技大学医学院张康共同通讯在Nature 在线发表题为“A vaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity”的研究论文,该研究发现包含S-RBD残基319-545的重组疫苗可在单剂后7或14天之初在免疫的小鼠,兔和非人灵长类动物(猕猴)中诱导有效的功能抗体应答。免疫动物的血清在体外阻断了RBD与细胞表面表达的ACE2的结合,并中和了SARS-CoV-2假病毒和SARS-CoV-2活病毒的感染。重要的是,该疫苗还为非人类灵长类动物提供了体内SARS-CoV-2攻击的保护。在接种了RBD免疫血清的小鼠和猴子没有观察到抗体依赖性肺炎增强或加速出现肺炎的不良反应。与包含整个细胞外蛋白部分(ECD)、S1-亚基蛋白或S2-亚基蛋白及S蛋白其他部分相比,重组RBD蛋白疫苗的病毒中和活性要高得多,因此重组RBD蛋白疫苗是作为免疫原的最佳疫苗选择。在COVID-19患者的血清中也发现了升高的RBD特异性抗体。几种免疫途径和CD4 T淋巴细胞与疫苗抗体反应的诱导有关。该研究发现突出了RBD结构域在SARS-CoV-2疫苗设计中的重要性,并通过诱导针对RBD结构域的抗体为保护性疫苗的开发提供了依据(点击阅读)。
2020年7月29日,中科院上海生化与细胞所许琛琦、北京大学黄超兰,美国加州大学圣地亚哥分校惠恩夫共同通讯在Cell在线发表题为“Multiple Signaling Roles of CD3ε and Its Application in CAR-T Cell Therapy”的研究论文,该研究使用定量质谱法,同时定量了TCR刺激后所有CD3链的免疫受体基于酪氨酸的活化基序(ITAM)的磷酸化。由于Lck激酶的选择性,CD3ε ITAM的亚群被单磷酸化,并专门募集了抑制性Csk激酶来减弱TCR信号传导,这表明TCR是一种自我约束的信号传导机制,既包含激活基元又包含抑制基元。此外,该研究发现将CD3ε胞质域整合到第二代嵌合抗原受体(CAR)中可改善CAR-T细胞的抗肿瘤活性。从机制上讲,CD3ε的Csk诱导ITAM减少了CAR-T细胞因子的产生,而CD3ε的基本残基富集序列(BRS)通过募集p85促进了CAR-T持久性。总的来说,CD3ε是内置的多功能信号调谐器,而不断增加的CD3多样性则代表了设计下一代CAR的策略(点击阅读)。

由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注。新型冠状病毒感染被认为是从动物传播的,病原体被鉴定为SARS-CoV-2。到2020年1月,怀疑最初受感染的患者是通过人与人之间的传播感染了该病毒。自2020年1月以来,该病毒已迅速传播到中国大部分地区和其他国家。由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注,病原体被鉴定为SARS-CoV-2。截至目前(7月29日),据约翰·霍普金斯大学发布的实时统计数据,全球累计新冠肺炎确诊病例超过1693万例,死亡人数达66万。这些数字每天都会更新,而且预计还会进一步增加。SARS-CoV-2利用人血管紧张素转化酶2(ACE2)作为受体与细胞结合。根据对病毒包膜蛋白的了解,该研究假设受体结合域(RBD)将是一种良好的免疫抗原原,可以触发强大的功能性抗体反应,从而在体外SARS-CoV- 2感染模型(非人类灵长类动物猕猴)中通过阻断病毒进入细胞。
选择杆状病毒表达系统来表达各种蛋白质,因为这是一种商业上可行的系统,如果成功,可以商业规模生产候选疫苗,并且所产生的疫苗通常具有正确折叠的蛋白质构象。实际上,该技术已在几种常用的疫苗产品中使用,包括目前在欧洲和美国市场上使用的某些宫颈癌疫苗和流感疫苗。这项研究的目的是评估基于SARS-CoV-2的RBD结构域的候选疫苗的潜力,评估合适的给药方案并测试其在受体中产生针对SARS-CoV-2的中和活性的作用 动物,并确定参与免疫应答产生的免疫途径,从而为设计有效的SARS-CoV-2预防性疫苗提供基础。具体而言,该研究发现包含S-RBD残基319-545的重组疫苗可在单剂后7或14天之初在免疫的小鼠,兔和非人灵长类动物(猕猴)中诱导有效的功能抗体应答。免疫动物的血清在体外阻断了RBD与细胞表面表达的ACE2的结合,并中和了SARS-CoV-2假病毒和SARS-CoV-2活病毒的感染。重要的是,该疫苗还为非人类灵长类动物提供了体内SARS-CoV-2攻击的保护。在接种了RBD免疫血清的小鼠和猴子没有观察到抗体依赖性肺炎增强或加速出现肺炎的不良反应。与包含整个细胞外蛋白部分(ECD)、S1-亚基蛋白或S2-亚基蛋白及S蛋白其他部分相比,重组RBD蛋白疫苗的病毒中和活性要高得多,因此重组RBD蛋白疫苗是作为免疫原的最佳疫苗选择。在COVID-19患者的血清中也发现了升高的RBD特异性抗体。几种免疫途径和CD4 T淋巴细胞与疫苗抗体反应的诱导有关。该研究发现突出了RBD结构域在SARS-CoV-2疫苗设计中的重要性,并通过诱导针对RBD结构域的抗体为保护性疫苗的开发提供了依据。
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247512612&idx=5&sn=6df7db550992dbc6334369f3cef78194&chksm=fce6c1fbcb9148edf1630c85ed355befd0bd47a8237e419494e29850ba74cffb913915df8c4a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn