科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-04
来源:BioArt
想要了解一个基因的功能,通常的做法是在DNA或mRNA水平抑制基因的表达,然后观察表型的变化,而表型的变化通常是由蛋白的缺失导致的。但是,这些方法没有直接作用于蛋白,只是暂停了蛋白质的转录或翻译,蛋白的缺失还是依赖于其自身的半衰期。因此,这些方法不能有效敲减半衰期长的蛋白或溶解度低的蛋白聚集体。在DNA或mRNA水平抑制蛋白的表达,通常需要较长的时间(>48 h),不能用于研究蛋白水平快速变化的生命过程,如细胞周期。正是因为时间的延迟,细胞有足够的时间启动其他补偿机制,弥补单个蛋白水平的下降,有可能掩盖了表型的变化。
为了可以直接降解目标蛋白,人们已经开发出了许多方法。Proteolysis targeting chimeras (PROTACs) 就是其中之一,它利用细胞本身的泛素-蛋白酶体系统来降解胞内蛋白(详情请见 BioArt :首个降解 KRAS^G12C 的高活性 PROTAC )。这项技术的局限之处在于,我们需要为目标蛋白找到高亲和力的小分子配体,这对于一些“不可被靶向”的蛋白来说往往是非常困难的。其他技术包括auxin inducible degron system【1, 2】、Trim-Away【3】和改造的纳米抗体【4, 5】等,这些方法需要对细胞内源蛋白进行改造,或需要特定外源蛋白的表达,各有优劣。
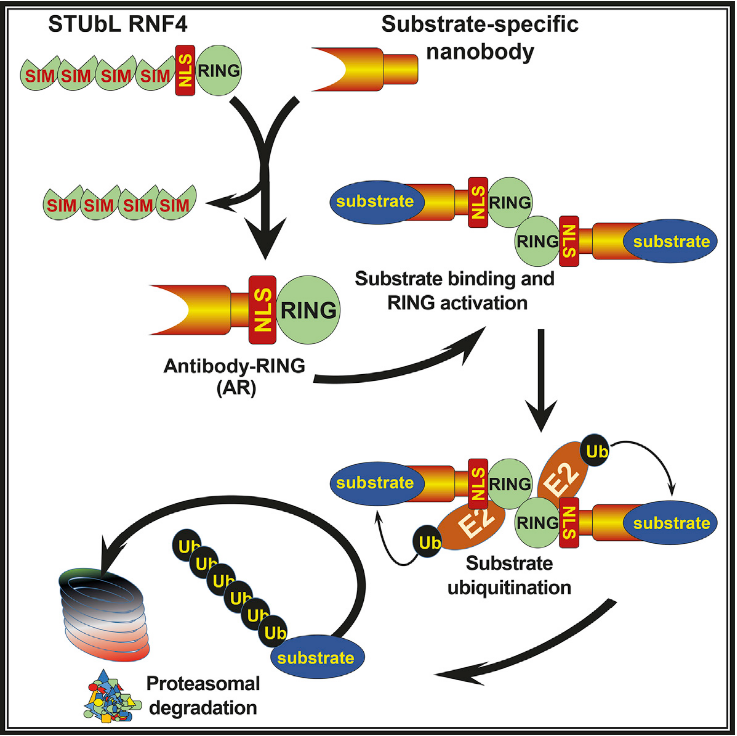
近日,University of Dundee的Ronald Hay课题组在Molecular Cell 上发表了题为Antibody RING-Mediated Destruction of Endogenous Proteins 的论文,报道了他们开发的Antibody RING-mediated destruction (ARMeD) 系统。研究者把E3泛素连接酶和骆驼纳米抗体组装在一起,引入细胞后可在数分钟内介导内源靶蛋白的降解,且没有检测到脱靶效应的存在。

E3泛素连接酶RNF4的C端为RING(Really Interesting New Gene)结构域,负责招募装载了泛素的E2。实验者把RING和特异性识别黄色荧光蛋白(YFP)的纳米抗体融合,成功在HeLa细胞引发了YFP-PARG(poly ADP ribose glycohydrolase) 融合蛋白的泛素化和依赖蛋白酶体的降解,初步证明了ARMeD系统的可行性。
接下来,作者要把ARMeD系统真正应用于细胞内源蛋白的降解。实验人员选定了一个靶点:NEDP1蛋白,并生产了一系列靶向NEDP1的骆驼纳米抗体。类似地,纳米抗体-RING融合蛋白成功促进了NEDP1的降解。更重要的是,研究人员通过蛋白质组学的方法,检测不到脱靶效应的存在,说明纳米抗体的专一性保证了ARMeD系统的高度特异性。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652494598&idx=7&sn=7183e4b0eefbda9114dbe0706ad8df75&chksm=84e248b2b395c1a494a076ecfbabdf2ffe8da812f5baa8b6d2fc51bb561a08db9b516e9ddf92&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
不用抗体也能做WB? 目标蛋白定量分析的新宠
中国化学会授予Richard A. Lerner教授荣誉会士称号
抗热休克蛋白-60抗体
乙型肝炎核心抗体免疫球蛋白G
乙型肝炎核心抗体免疫球蛋白M

癌症免疫疗法几年内或有更大突破
抗肌球蛋白抗体
功能性抗体怎么玩,不知道你就 out 了

Lancet neurol:Eculizumab,补体蛋白C5的单克隆抗体
中和细菌细胞壁碎片可改善小鼠自身免疫 |《自然-微生物学》