科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-10
来源:中国高科技、中国科学院
蛋白质半胱氨酸Cys上的谷胱甘肽化修饰作为一种可逆的氧化还原修饰,一方面可以保护蛋白免于发生磺酸化(-SO3H)等不可逆的氧化损伤,另一方面和磷酸化修饰一样发挥信号转导功能,传递氧化还原信号。Hsp70是蛋白质质量控制体系中的核心分子伴侣,对于生命体稳态平衡有极为重要的意义。除极少数Hsp70之外,大部分Hsp70都有至少1个Cys。深入挖掘Hsp70的氧化还原修饰机制,对帮助揭示蛋白质稳态的氧化还原调控机制及拓展对Hsp70功能的认识具有意义。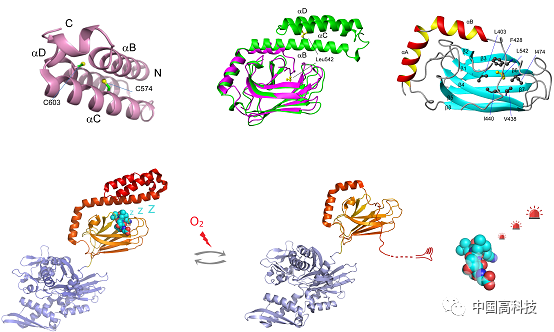
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650050669&idx=1&sn=6ce961c621683e70ef45875f1eb2b3cc&chksm=87386414b04fed02c37a2de9c99b9305e966b8a912d2d428135eeda104be58a7f9cb10b35f90&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
蛋白质纤维

血液黏稠的4个信号,很多人没注意血管就堵了

【学科发展报告】脑机接口技术
蛋白质之间发生了什么?
蛋白质浓度测定

自然中不存在的蛋白质也能人造了!撼动材料医药界

脑控武器:让敌人主动缴械投降

稳中求进 精准施策——从中央政治局会议看下半年中国经济六大信号
蛋白质浓度测定

Cell | 中科院生物物理所张宏组再一次突破,在自噬领域取得重大进展