科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-11
来源:Nature自然科研

原文作者:Magomet Aushev & Mary Herbert
研究人员发现的一种细菌毒素可以精准改变线粒体内的DNA。这项进展或能帮助治疗线粒体DNA突变引发的疾病。
线粒体DNA只编码13种蛋白,所有这些蛋白都参与生产细胞所需的能量。人体中的线粒体DNA(mtDNA)突变会导致一系列不可治愈、限制生活的代谢疾病[1]。因此,mtDNA编辑工具的开发成了线粒体遗传学长期以来的一个目标。Mok等人[2]在《自然》发文,报道了利用一种分子工具首次实现了对mtDNA的精准编辑。这项成就的关键在于发现了细菌分泌的一种毒素,这种毒素可以杀死周围细菌。
Mok等人发现的细菌毒素是一种胞苷脱氨酶,名为DddA。DddA能催化核苷酸碱基胞嘧啶(C)转化成尿嘧啶(U)。DddA的一个显著特征是它能靶向双链DNA,而之前鉴定[3]的所有胞苷脱氨酶都只靶向单链DNA。关键的一点是,虽然传统基因组编辑手段依靠核酸酶作为分子剪刀来剪切DNA双链,但DddA将C转化成U却不需要诱导双链DNA断裂。这个特点尤其适合用来编辑线粒体基因组——目前仍缺少能修复双链DNA断裂的高效机制[4]。
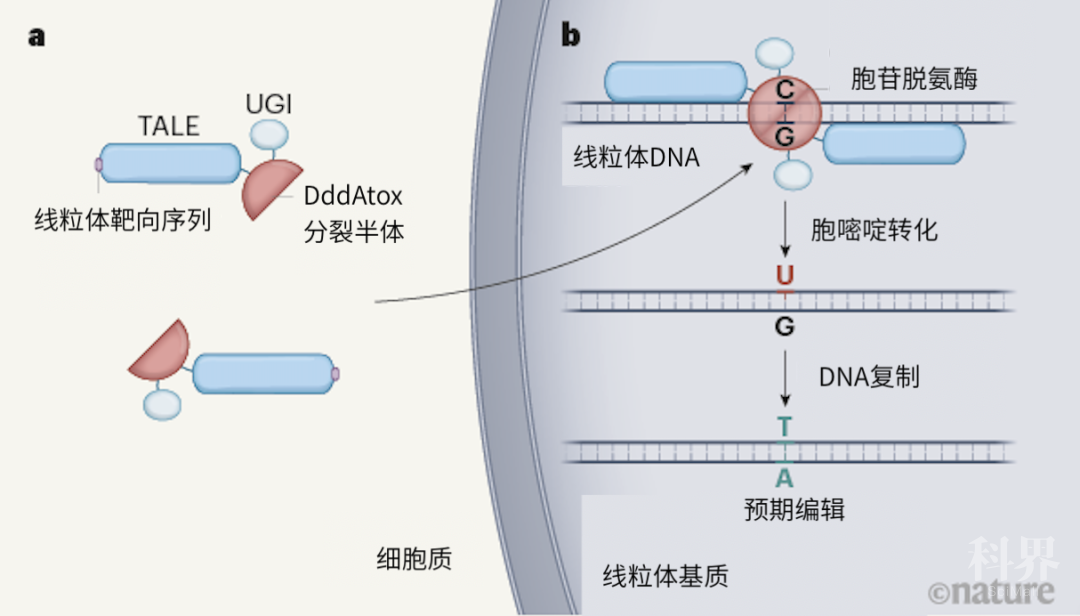
要将DddA用于线粒体基因组编辑,研究人员需要克服许多挑战。最大的问题在于胞苷脱氨酶对哺乳动物细胞有毒。为此,Mok等人将DddA 的毒素结构域分成两个不活跃的部分,称为DddAtox分裂半体(split-DddAtox halves)。他们将这两个半体与TALE蛋白融合,再经过工程改造与特定DNA序列结合。将两个TALE蛋白与mtDNA结合,就能让两个DddAtox分裂半体合在一起,恢复它们的活性。
为了能递送到线粒体基质内的mtDNA,TALE–DddAtox分裂半体必须穿过线粒体的双层膜。Mok等人用一个氨基酸序列作为线粒体靶向信号,标记这个构建物。由于能够利用既有的蛋白输入机制(protein-import machinery)[5],该技术拥有RNA引导的基因组编辑系统(如CRISPR–Cas9)所没有的关键优势。CRISPR技术对mtRNA不是很有效,可能是因为细胞没有能把RNA导入线粒体的机制[6]。
另一个挑战来自胞苷脱氨酶是将C转化成U,而不是DNA特异性碱基胸腺嘧啶(T)。虽然U和T具有相同的碱基配对特性,但U属于RNA。DNA通常会在尿嘧啶-DNA糖基化酶的帮助下将碱基U切掉,用C取而代之[7]。
因此,Mok等人将TALE–DddAtox分裂半体与一种尿嘧啶糖基化酶抑制剂(UGI)融合。这么做能保护U不被糖基化酶剪切,保留到下一次DNA复制或修复,那时互补链上在编辑前与C配对的鸟嘌呤(G)——就能被与T配对的腺嘌呤(A)取代。UGI的加入让胞嘧啶碱基编辑效率提升为原来的8倍左右。
最后得到的构建物被称为DddA源胞嘧啶碱基编辑器(DddA-derived cytosine base editor,DdCBE),含有一个线粒体靶向信号、一个TALE蛋白、一个DddAtox分裂半体和一个UGI(图1)。Mok等人表明,这个构建物可以被有效输入到人体细胞的线粒体内,修饰一连串的线粒体基因。C-G碱基对到T-A碱基对的编辑发生率为5-50%。编辑的效率受多个因素影响,包括两个DdCBE亚基之间的间隔、TALE的设计、DddAtox分裂半体的方向、靶点胞嘧啶相对于TALE结合位点的位置。
图片来自Nature
评价基因组编辑工具的一个主要考量是看它会不会修饰非预期位点的DNA。Mok等人对比了处理组和未处理组的细胞,未在细胞核基因组中发现脱靶效应。mtDNA内的脱靶活性也较低,只有一个基因发生了与TALE设计相关的脱靶编辑。
接下来,Mok等人检验了DdCBE的治疗潜力。作者报告称,胞嘧啶碱基编辑有望修正49%的已知有害的mtDNA突变。不过,DdCBE的当前形式只能有效编辑出现在基因组T后面的C碱基,编辑范围有限。
DdCBE依赖DNA复制来实现C-G向T-A的转化,这说明理论上的编辑效率最高可达50%。也就是说,两个新复制的mtDNA各自接收了一条亲代DNA链,其中一个不会被编辑,含有G,与C配对。但是,Mok等人发现,DdCBE的活性能维持好几天,或能在后续的复制活动中提供进一步编辑的机会。长时间DdCBE暴露是否会增加脱靶效应将是一个需要探索的重要问题。
这些注意事项告诉我们,DdCBE不会让mtDNA突变完全消除,但可以让它们减少。考虑到mtDNA疾病症状的严重性会随突变负荷增加[8],能够降低突变水平本身就具有一定的治疗前景。
线粒体靶向的核酸酶此前被用来清除小鼠体内的特异性mtDNA突变[9,10]。这之所以可行,是因为它们引起的双链断裂会让mtDNA降解。细胞内含有许多mtDNA的拷贝,只有携带有害突变的拷贝才会被降解。但这存在一种风险:如果突变负荷较高,清除突变的mtDNA可能会让mtDNA的拷贝数降至有害的水平。一旦全部mtDNA拷贝都携带相同的突变,就无法使用这种核酸酶策略。相比之下,碱基编辑在减少携带突变的mtDNA的同时不会降低拷贝数,这在突变负荷较高的情况下或是首选(或唯一)的策略。
DdCBE有潜力预防 mtDNA疾病的传播吗?由于mtDNA一般只遗传自母亲,所以目前的线粒体替代疗法是将携带突变mtDNA的女性卵子的核基因组移植到完好的供卵中,降低mtDNA突变的传播[11]。减少卵子或早期胚胎中突变负荷的碱基编辑或能成为一种理论上可行的替代疗法。不过,mtDNA复制被认为不会在人类发育的最初5-6天内发生[12],因此,想要取得成功可能需要延长对U的保护。
Mok等人的工作是针对mtDNA疾病的基因疗法开发的一项重要进展。不仅如此,利用这种工具实验性地改变线粒体基因组,我们可以更好地理解mtDNA突变在复杂疾病、癌症、年龄相关性细胞功能损伤中的相关性。这项研究还有望促进蛋白工程及演化的未来发展,提升DdCBE的范围和效率;同时加强对其他候选碱基编辑器的搜索。
参考文献:
1. Russell, O. M., Gorman, G. S., Lightowlers, R. N. & Turnbull, D. M. Cell 181, 168–188 (2020).
2. Mok, B. Y. et al. Nature 583, 631–637 (2020).
3. Salter, J. D. & Smith, H. C. Trends Biochem. Sci. 43, 606–622 (2018).
4. Moretton, A. et al. PLoS ONE 12, e0176795 (2017).
5. Schmidt, O., Pfanner, N. & Meisinger, C. Nature Rev. Mol. Cell Biol. 11, 655–667 (2010).
6. Gammage, P. A., Moraes, C. T. & Minczuk, M. Trends Genet. 34, 101–110 (2018).
7. Kunz, C., Saito, Y. & Schär, P. Cell. Mol. Life Sci. 66, 1021–1038 (2009).
8. Hellebrekers, D. M. E. I. et al. Hum. Reprod. Update 18, 341–349 (2012).
9. Bacman, S. R. et al. Nature Med. 24, 1696–1700 (2018).
10. Gammage, P. A. et al. Nature Med. 24, 1691–1695 (2018).
11. Greenfield, A. et al. Nature Biotechnol. 35, 1059–1068 (2017).
12. St. John, J. C., Facucho-Oliveira, J., Jiang, Y., Kelly, R. & Salah, R. Hum. Reprod. Update 16, 488–509 (2010).
原文以Mitochondrial genome editing gets precise为标题发表在2020年7月8日的《自然》新闻与观点版块
© nature
doi: 10.1038/d41586-020-01974-6
点击“阅读原文”阅读英文原文
由于近期微信订阅号的规则更改,很多朋友反映不能快速找到我们。小编建议大家可以将Nature自然科研设置为星标?,这样就能在微信公众号中发现我们,查看每天订阅。
具体步骤:

快去试试吧!
版权声明:
本文由施普林格·自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转发至朋友圈,如需转载,请邮件China@nature.com。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
© 2020 Springer Nature Limited. All Rights Reserved

喜欢今天的内容吗?喜欢就点个“在看”吧⇣⇣
来源:Nature-Research Nature自然科研
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwNTAyMDY0MQ==&mid=2652576686&idx=1&sn=ecd904e4b08af65384aaee2f2bf74891&chksm=80ccb520b7bb3c3638ed2de41b50b597a27901641697abc19077bc8ce4e9be32e03706260f71&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科普 科学 DNA 线粒体 线粒体dna 突变理论 dna修复 dna复制
发现线粒体DNA突变引发肠衰老机制与逆转方案

研究发现线粒体DNA缺失综合征铁死亡病理

测量线粒体DNA损伤可预测帕金森病
科学家揭示人体线粒体DNA复制及分配新机制
Nature亮点 | 突变的线粒体DNA如何选择与被清除?

自然中不存在的蛋白质也能人造了!撼动材料医药界

【大师讲堂】线粒体中的DNA复制是如何被调控的?
Nature、PNAS齐发文,线粒体DNA竟然可以双亲遗传

三手烟有损细胞DNA和线粒体

首次利用特殊细菌毒素来精确编辑线粒体DNA