科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-14
来源:X一MOL资讯
肿瘤乏氧微环境(TME)是实体肿瘤的重要特征之一,它与肿瘤的发生、发展、转移以及耐药等密切相关。改善肿瘤部位的乏氧状况、提高氧浓度且实现持久高效的供氧对肿瘤治疗十分重要。近年来,用于成像协同抗肿瘤治疗的多功能纳米载药体系在生物医学应用有着广泛的应用前景,但如何构建集癌症成像与治疗一体化且可响应肿瘤乏氧微环境实现高效持续产氧的纳米诊疗体系是一个亟待解决的问题。
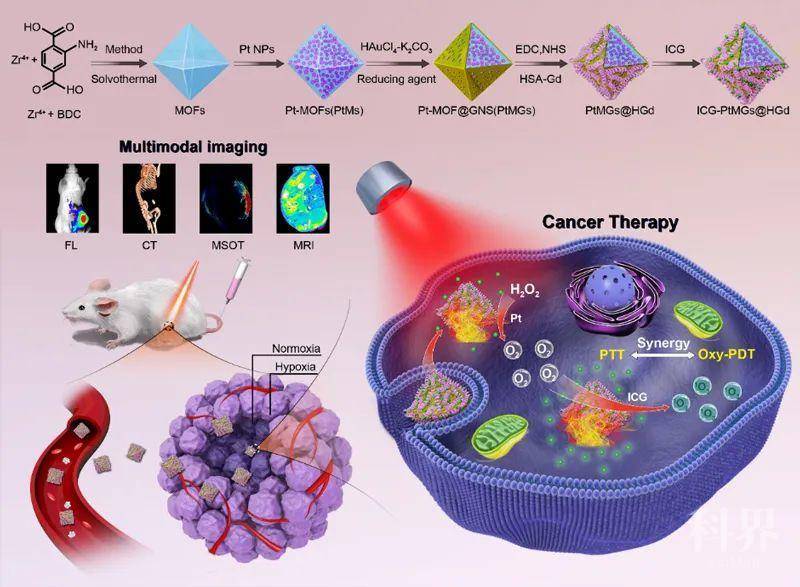
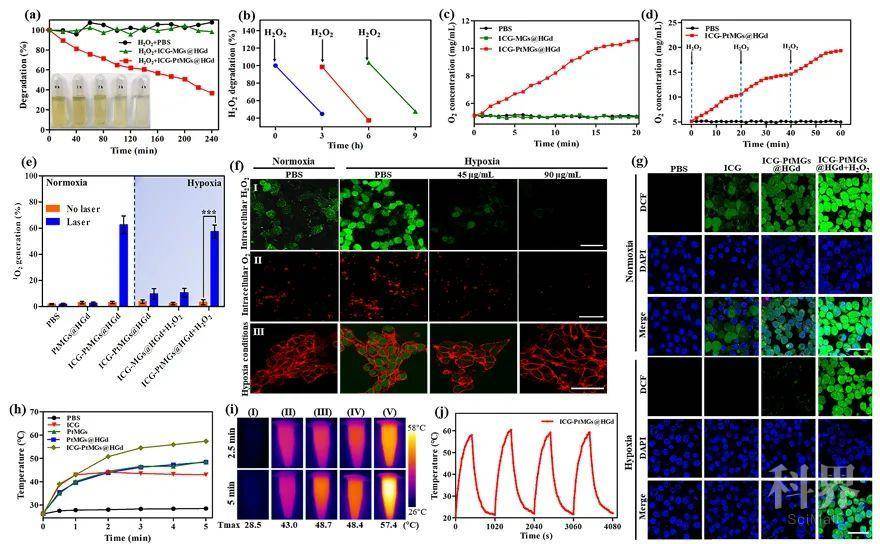
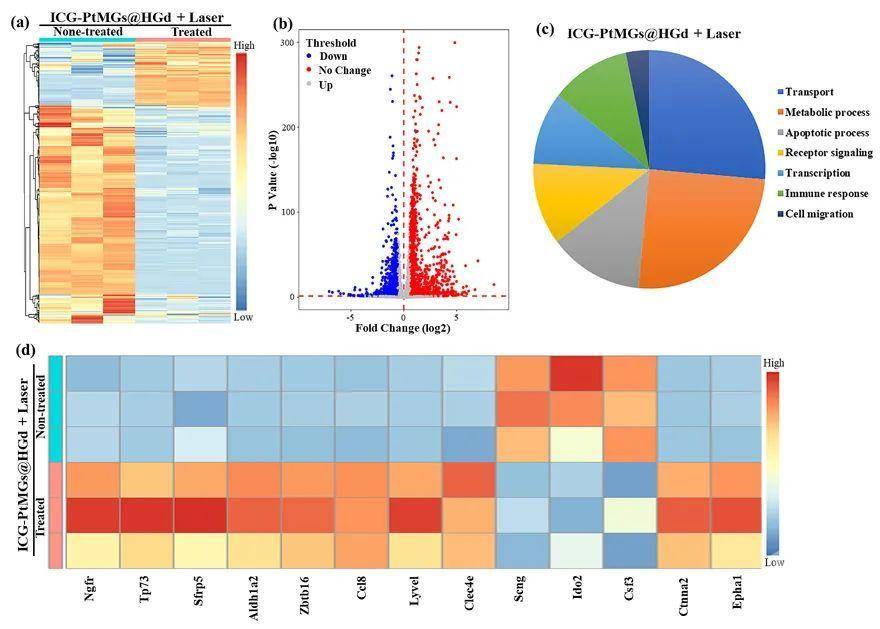
来源:X-molNews X一MOL资讯
原文链接:https://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657654602&idx=6&sn=9cd6a4826671b9d5cfb4786d0122759f&chksm=80f8be9ab78f378c987ee6e1c8628e26d2d89c1c05019460508c06984301a8a469be0bc44610#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国—奥地利纳米科技及新材料研讨和对接洽谈会在深圳举行




【纳米】基于荧光共振能量转移的增强型光敏剂用于肿瘤光动力治疗

【走近桂籍科学家】用纳米武装电池新世界

中国科学家研发出新型纳米发光材料,助力肿瘤光动力治疗
一种克服分级光动力治疗自我限制的肿瘤微环境调控与报告的纳米粒子

中国科学家合成新型纳米发光材料有望用于肿瘤光动力治疗等
【纳米】具有AIE效应的金纳米簇发光体实现低辐射剂量的耐辐射肿瘤的光动力治疗
小小纳米球!即可破除肿瘤缺氧和内在抗氧化,助力光动力学疗法
含可伸缩锌卟啉的硫化铋纳米系统用于肿瘤的高效光动力清除
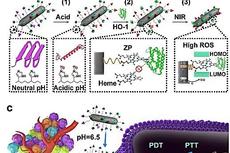

【纳米】聚合增强双光子光敏效应实现精准光动力肿瘤治疗