科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-21
来源:中国生物技术网
北京时间2020年8月20日晚23时,Stem Cell Reports发表了中国科学院动物研究所团队最新研究成果。
在这篇文章中,研究人员构建了一种新的透明免疫缺陷突变体斑马鱼模型foxn1/Casper,它可以在不经过前处理的情况下移植同种或异种来源的细胞。
中国科学院动物研究所膜生物学国家重点实验室刘峰研究员,中国医学科学院天津血液所实验血液学国家重点实验室王璐研究员为该论文的共同通讯作者。动物所博士研究生吕鹏、高帅、张一帆和马东媛副研究员以及韩国国家肿瘤中心Young-Ki Bae博士为共同第一作者。

近年来被广泛关注的斑马鱼细胞移植平台,它有着成本低,通量高,易观察等优势。
造血干细胞移植是评价造血干细胞特性和临床治疗恶性血液疾病的重要手段[1]。造血干细胞移植评价受体往往需要辐照处理,但辐照同时也破坏了造血干细胞生存的“微环境”[2]。
透明斑马鱼Casper突变体的构建,极大的推动了成年斑马鱼移植模型可视化的发展[3]。随后的研究中,通过将免疫缺陷斑马鱼与Casper斑马鱼进行杂交,得到了一系列可视化免疫缺陷斑马鱼移植平台,如prkdc-/-/il2rga-/-/Casper移植模型可以实现人肿瘤细胞的移植,并进行药物筛选[4]。
然而,已有的免疫缺陷模型存活率较低,且纯和突变体往往不育,同时造血干细胞移植的评价缺少发育时期依赖性特征。
之前的研究表明,在斑马鱼中foxn1的敲低将导致胸腺上皮细胞发育缺陷,造成T细胞成熟受阻[5]。在此基础上,研究人员通过ZFN技术构建了斑马鱼foxn1免疫缺陷突变体,并通过与Casper突变体杂交,得到了斑马鱼foxn1/Casper突变体移植平台。
斑马鱼foxn1/Casper突变体在无抗生素环境中存活率达到了65%(150天),且雌鱼可育。进一步表型鉴定发现,foxn1/Casper突变体胸腺萎缩,发育早期和成体期T细胞数量均减少且功能缺陷。
随后,通过对比不同受体中造血干细胞移植效率,发现不辐照的foxn1/Casper受体与辐照后Casper受体中造血干细胞移植效率没有显著差异,但foxn1/Casper受体进行造血干细胞移植后存活率更高。表明辐照会对受体造成损伤,影响造血干细胞移植后受体的存活。
随后,研究人员利用不辐照的foxn1/Casper突变体评价了胚胎期和成体期造血干细胞的移植效率,发现胚胎期造血干细胞有更好的移植效率。进一步RNA-seq数据表明,胚胎期造血干细胞的细胞周期更快,这可能是其有更好移植效率的原因之一。
接下来,研究人员通过分别移植斑马鱼和青鳉鱼肌肉细胞,表明其可以作为同种或异种实体细胞的移植受体;通过移植斑马鱼来源的MDS-like细胞,表明其可以作为恶性血液细胞的移植受体。
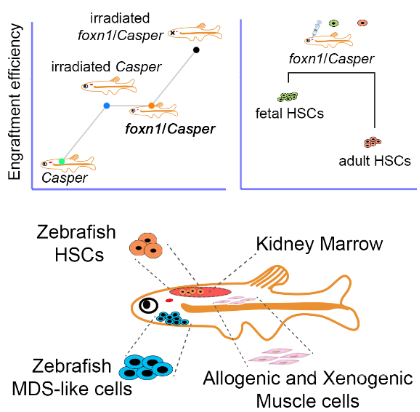
图1. 斑马鱼foxn1/Casper突变体细胞移植平台及应用
综上所述,该工作构建了新的斑马鱼foxn1/Casper突变体移植平台,不需要辐照前处理,可以用于造血干细胞移植评价,同时能接受同种或异种的肌肉细胞移植,以及斑马鱼恶性血液细胞的移植。
该工作丰富了免疫缺陷斑马鱼移植平台,鉴于foxn1/Casper突变体的免疫缺陷和透明等特征,该模型可进一步应用于研究正常细胞移植后的命运以及恶性细胞的生理病理事件。
来源:biotech-china 中国生物技术网
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653953101&idx=3&sn=ec8f08bbd442208df3ab221befcf31d3&chksm=bd0cec248a7b65326f50b7a6cef51378791d341fa3dea4209b8854efb8754a2cad6e0ad3b293&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
人类免疫缺陷病毒抗体
微塑料,让淡水斑马鱼也很“受伤”

免疫细胞缺陷或为衰老元凶
胚胎移植后可以正常活动吗?

中国首批“试管狗”在北京诞生
斑马鱼出生就识数!
斑马鱼研究探秘癌症基因“沉默”机制

斑马鱼睡眠过程与哺乳动物等类似
房龙后/柏永坪/陈开富合作组揭示胆固醇代谢在造血干细胞发育中的作用

今日科技话题丨高效利用太阳能 “密码”破译、我国将开展未来核燃料辐照性能考核、测绘地理增添科技含量