科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-06
来源:BioArt
撰文 | 稻
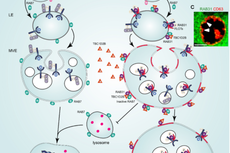
细胞外囊泡(extracellular vesicles,EVs)是由细胞分泌的具有双层磷脂膜结构的囊泡小体,绝大多数细胞均可分泌。细胞外囊泡中可以携带蛋白质、脂质和核酸等多种生物活性成份,介导体内细胞间远程通讯【1】。根据大小分类,EVs可以分为直径小于200纳米的sEVs(small extracellular vesicles)和直径大于200纳米的lEVs(Large extracellular vesicles)。根据其来源分类,细胞外囊泡主要可以分为来源于多囊泡体(multivesicular endosomes,MVEs)的外泌体(Exosomes,30-50 nm)和来源于细胞质膜(Plasma membrane)的微体(Microvesicles,100-1000 nm)【2】。
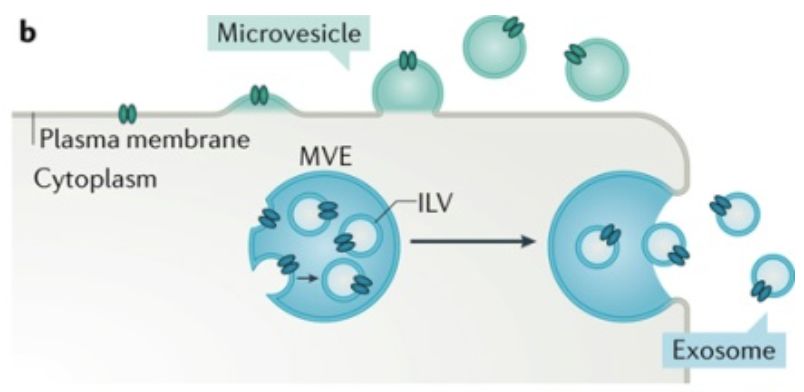
随着外泌体的研究的增加,人们逐渐发现,在外泌体样品(“exosomal” samples)中不仅仅包含sEVs,同时还会混杂着“不含膜性结构”的NV组分(non-vesicular compartments)。而NV组分带来的异质性往往会对外泌体组成成分及功能的研究产生干扰和混淆。目前,分离纯化细胞外囊泡的方法主要有四类,即超高速离心法、过滤法、沉淀法和免疫富集法。这些分离方法没有明确的将sEVs与NV组分分开,因此可能会对后续的分析产生干扰。同时,目前鉴定出来可以作为外泌体标记物的经典分子有CD63、CD81和CD9【3】,然而还没有发现进一步区别微体和外泌体的特异标记物。
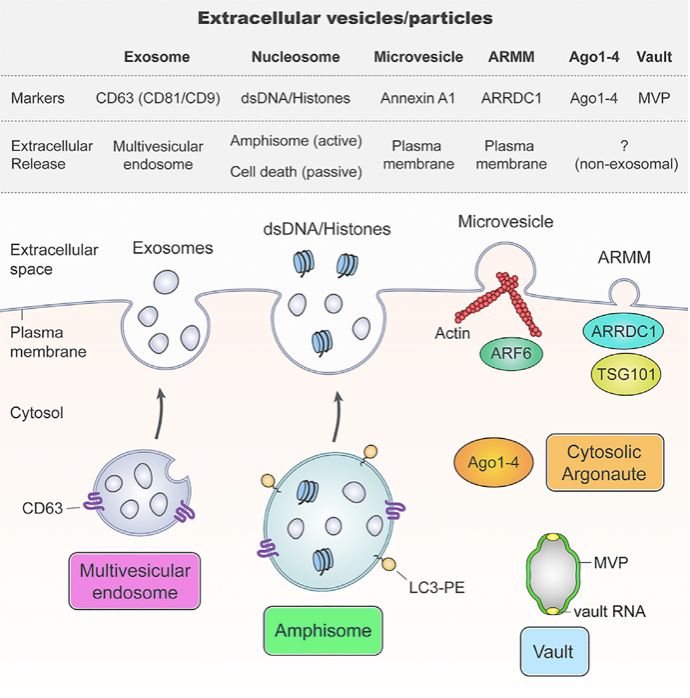
2019年4月4日,来自美国范德堡大学医学中心的Robert J. Coffey课题组在Cell发表题为Reassessment of Exosome Composition的研究,研究人员通过高分辨率密度梯度离心结合免疫亲和捕获的技术将外泌体从NV组分中分离,并发现Ago1-4以及MVP蛋白的分泌不依赖于外泌体,并且Annexin A1可以做为来源于细胞膜的微体的标记物以区别于来源于内体的外泌体。同时,细胞外DNA的分泌并不依赖于外泌体,而是依赖于内吞自噬融合体介导的途径。

首先,研究人员使用传统的差速离心的方法分离了DKO-1细胞系和胶质母细胞瘤细胞(Gli36)的lEVs(P15)和sEVs(P120),再通过高分辨率密度梯度离心(High-Resolution Density Gradient Fractionation)进一步分离得到的包含有sEVs的P120组分。通过检测CD63和CD81表明,该实验采用的高分辨率密度梯度离心可以很好的将sEVs和NV组分分离。
接下来,研究人员通过液相色谱-质谱串联技术以及RNA-seq技术分别分析sEVs和NV组分中的蛋白和细胞外RNA成分,发现之前认为很多存在于外泌体组分中的蛋白及RNA其实更多的存在于NV组分中。
在RNA结合蛋白方面,研究人员通过“直接”免疫亲和捕获技术(Direct Immunoaffinity Capture,DIC)发现,包括miRNA结合蛋白Ago1-4以及hnRNPA2B1、GAPDH和穹窿体主蛋白(major vault protein,MVP)等的分泌并不依赖于外泌体。同时,包括丙酮酸激酶(pyruvate kinase M1/2,PKM)在内的糖酵解酶和细胞骨架蛋白以及与外泌体生成有关的RAB GTPase等也不在外泌体组分中。
在膜结合蛋白方面,研究人员通过改变密度梯度离心的组分并且结合SIM(Structured illumination microscopy)成像,发现Annexin A1和A2标记的EVs能够很好的区分于经典的外泌体,同时Annexin A1能够作为来自细胞质膜的微体的标记物。
在之前的研究中,外泌体被报道含有双链DNA(double stranded DNA,dsDNA)以及组蛋白【4-5】。然而,在这项研究中,研究人员发现双链DNA和组蛋白更多的位于NV组分中,而不是外泌体或者sEVs中。进一步通过SIM成像,研究人员发现双链DNA和组蛋白定位于CD63和LC3B阳性的内吞自噬融合体(amphisomes)中,并且能够出现在细胞质膜的部位。因此,研究人员提出DNA分泌是依赖于自噬和多泡内体,而不依赖于外泌体。
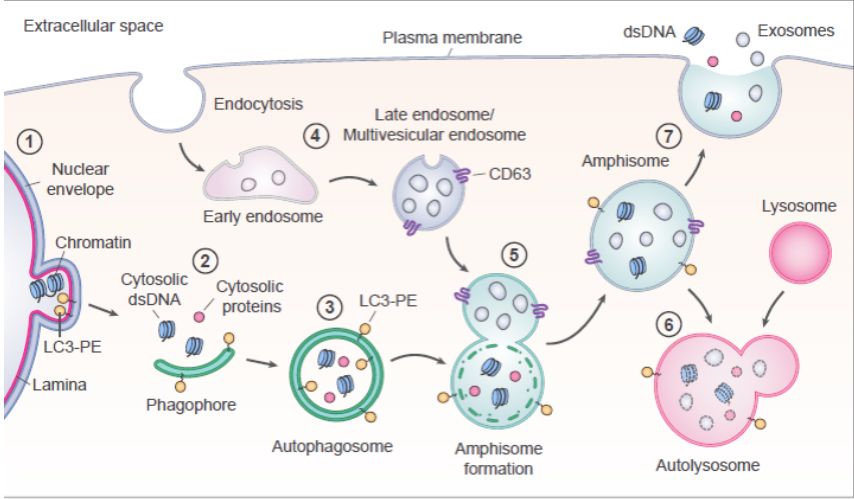
总之,该研究通过高分辨密度梯度离心以及“直接”免疫亲和捕获两种技术手段的结合,将sEVs与细胞外NV组分分开,从而更精确地鉴定了以CD63、CD81和CD9为标记物的经典外泌体中的蛋白和RNA等分子组分,为细胞外囊泡的异质性提供了更深入的认识,同时为将来通过细胞外囊泡进行疾病诊断和治疗提供了重要的帮助。
原文链接:
https://doi.org/10.1016/j.cell.2019.02.029
制版人:珂
参考文献
1. Mathieu, M., Martin-Jaular, L., Lavieu, G., and Thery, C. (2019). Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol 21, 9-17.
2. van Niel, G., D'Angelo, G., and Raposo, G. (2018). Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Bio 19, 213-228.
3. Kowal, J., Arras, G., Colombo, M., Jouve, M., Morath, J.P., Primdal-Bengtson, B., Dingli, F., Loew, D., Tkach, M., and Thery, C. (2016). Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. P Natl Acad Sci USA 113, E968-E977.
4. Montermini, L., Meehan, B., Gamier, D., Lee, W.J., Lee, T.H., Guha, A., Al-Nedawi, K., and Rake, J. (2015). Inhibition of Oncogenic Epidermal Growth Factor Receptor Kinase Triggers Release of Exosome-like Extracellular Vesicles and Impacts Their Phosphoprotein and DNA Content. J Biol Chem 290, 24534-24546.
5. Takahashi, A., Okada, R., Nagao, K., Kawamata, Y., Hanyu, A., Yoshimoto, S., Takasugi, M., Watanabe, S., Kanemaki, M.T., Obuse, C., et al. (2018). Exosomes maintain cellular homeostasis by excreting harmful DNA from cells (vol 8, 15287, 2017). Nat Commun 9.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468396&idx=2&sn=0af369c5d57c77252c848548ed46f4d5&chksm=84e2e718b3956e0e53e5b16885ecd9b6e7ed96216dc48b7a37523d04567ef6a246a4fc8b2d5e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

干细胞外泌体促进角膜损伤修复研究获进展
外泌体最新研究进展

DNA到底能不能预测外貌?

外泌体最新研究进展!
合成生物学: 一个用来控制转基因生物的内置毁灭开关
康铁邦团队发现新的外泌体通路

Cell Research:发现新的外泌体通路
外泌体研究新突破,康铁邦团队发现全新外泌体形成通路
外泌体在肿瘤和极端条件中的作用和检测

自然中不存在的蛋白质也能人造了!撼动材料医药界