科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-11
来源:iNature
原标题:先发Nature immunology,再登Molc Cell,NIBS邵峰团队取得系列进展
死亡受体信号传导对细胞死亡,炎症和免疫稳态至关重要。死亡受体信号通过跨膜死亡受体的肿瘤坏死因子受体(TNFR)家族的死亡域(DD)与下游衔接子(包括TNFR1相关死亡域蛋白(TRADD),受体相互作用的丝氨酸/)之间的同型或异型相互作用来介导。在被同源配体激活后,死亡受体包括FAS,TNF相关凋亡诱导配体(TRAIL)受体1(TRAIL-R1,也称为DR4)和TRAIL-R2(DR5)募集FADD等形成死亡诱导信号复合物(DISC)。死亡域相互作用的缺陷破坏了死亡受体信号传导,这通常会导致疾病表现
2019年4月9日,北京生命科学研究所邵峰团队在Molecular Cell上发表题为“Structural and Functional Insights into Host Death DomainsInactivation by the Bacterial Arginine GlcNAcyltransferase Effector”的文章,解析了NleB单体(酶单体),NleB/FADDDD/UDP复合体(酶/底物/糖基配体三元复合体),发生精氨酸N-乙酰葡萄糖胺化修饰的RIPK DD和TRADD DD(修饰后的两个蛋白底物),发现NleB的催化机理不同于以往报道的来自细菌的多个O-连接糖基转移酶(Lgt1,a-Toxin,TcdA/B,PaTox等),是一种“翻转型”糖基转移酶,揭示精氨酸N-乙酰葡萄糖胺化修饰的酶学机理,酶和底物识别机制以及其酶学活性在动物感染模型中的作用。
于此同时,2019年4月8号,邵峰团队等人在Nature immunology上发表了Innate immunity to intracellular LPS的综述性文章。在这里,研究人员回顾了关于细胞溶质LPS感知及其调节和病理生理功能的最新研究进展(点击阅读)。

NleB N-乙酰葡萄糖胺化TRADD-DD的Arg235。在该结构中,Arg235上存在明显的额外电子密度,可以用GlcNAc基团明确建模。这一发现为精氨酸N-乙酰葡萄糖胺化修饰提供了最直接的证据。 GlcNAc与精氨酸胍的Nε原子共价连接,产生产物抗-N-乙酰葡萄糖胺化。在RIPK1-DD结构中仔细检查Arg602,相当于TRADD-DD的Arg235,也显示了通过b-端基异构构型与Nε原子连接的GlcNAc的高质量电子密度。
此外,与TRADD-DD中的抗N-乙酰葡萄糖胺化相反,RIPK1-DD的Arg602的修饰呈现为syn- N-乙酰葡萄糖胺化。因此,死亡结构域的NleB修饰产生N-乙酰葡萄糖胺化产物的多种立体异构体。
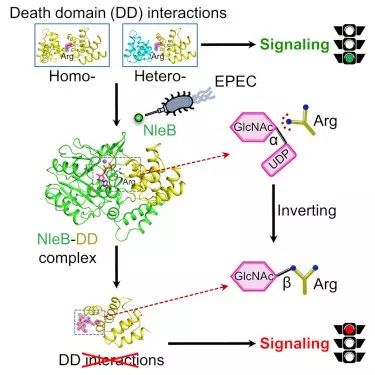
肠致病性大肠杆菌NleB和相关的III型效应物催化死亡结构域(DD)蛋白的精氨酸N-乙酰葡萄糖胺化以阻断宿主防御,但潜在的机制是未知的。在该研究中,研究人员解决NleB的晶体结构,并与FADD-DD,UDP和Mn2 +以及TRADD和RIPK1的NleB-精氨酸N-乙酰葡萄糖胺化DDs复合。
酶 - 底物复合物和产物结构的分析揭示了反转的糖转移反应和详细的催化机制。这些结构通过体NleB介导的精氨酸N-乙酰葡萄糖胺化的诱变分析及其在小鼠感染中的功能来验证。该研究构建了一个结构框架,用于理解NleB催化的宿主死亡域的精氨酸N-乙酰葡萄糖胺化。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30187-X
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247500267&idx=5&sn=ec16f35fffab6f0e610061ad5b851c3a&chksm=fce6b234cb913b22b93321123f947e394cc3157e66e9c95d31407380378afbce40b2a887ac51&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
淮安市科协春节走访慰问邵峰院士



Cell | 再取新突破,邵峰团队揭示吞噬细菌的分子机制

邵峰院士:北生所没有“科研绩效”概念,实验室主任无需每年汇报
邵峰院士团队发现GSDMB被颗粒酶激活进而诱导靶细胞发生焦亡

【对话】邵峰:不能因为惧怕失败而失去挑战困难的信心
邵峰组破解细菌感染介导自噬的机制,为选择性自噬通路的研究提供新思路




邵峰博士当选2019德国科学院院士

邵峰:做科研,我喜好分明

【喜报】2020年度北京市科学技术奖揭晓,邵峰、刘光慧获奖!

【人物聚焦】邵峰院士:北生所没有“科研绩效”概念,实验室主任无需每年汇报