科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-14
来源:X一MOL资讯
核酸功能化修饰的金纳米颗粒(DNA-AuNPs)在过去二十年是化学、材料、生物领域的研究热点,吸引了大量科研工作者的关注。该纳米颗粒已经被广泛应用于纳米加工、光电器件、生物传感、疾病诊断和肿瘤治疗等领域。得益于DNA分子的特异性识别、严格的Watson-Crick碱基互补配对原则和结构可编程性,功能化的DNA不仅可以作为敏感的“鼻子”检测目标物,还可以作为坚实的“手臂”用于自下而上地组装纳米颗粒超结构。在许多情况下,控制金纳米颗粒表面修饰DNA分子的数量和位置是非常重要的,尤其是当用于精准诊断、逻辑传感和价态可控组装等研究中。然而,控制金纳米颗粒表面的DNA功能化是一个艰难的挑战。挑战的难点在于,连接金纳米颗粒和DNA的巯基共价键在盐老化条件下不具有选择性和特异性。传统上,为了获得DNA规定数量修饰的纳米颗粒,可以通过凝胶电泳分离和阴离子交换液相色谱等方法。另外,也有很多工作提出了一些关于控制DNA修饰位置和各向异性功能化的策略。然而,同时控制金纳米颗粒表面功能化DNA分子的数量和位置仍是一个难题。
针对这一难题,湖南大学王柯敏和黄晋团队发展了一种DNA分子三维转印策略,借助DNA二十面体纳米笼将DNA分子转移修饰到内含的金纳米颗粒表面。DNA二十面体纳米笼是由DNA模块分步组装形成的三维纳米结构,两个半二十面体通过杂交互补形成完整的二十面体,并能包裹一个金纳米颗粒于空腔中。待转移的DNA分子通过巧妙的结构设计和核酸序列延伸的方式编码在二十面体纳米结构中。在去掉外围的二十面体骨架之后,通过金巯键共轭到颗粒表面的编码DNA分子则被保留下来。由于本设计中的DNA二十面体具有三十个缺刻位点可以用于编码和序列设计,理论上该模板可以自由地在整个金颗粒表面进行分子转移。为了验证上述想法,作者进行了一系列实验。首先通过电泳、透射电子显微镜、动态光散射、紫外可见光吸收光谱等技术证明DNA二十面体的组装和对尺寸适配的金纳米颗粒的成功包裹。然后他们设计了多种二十面体编码模板,研究DNA分子从单链到多链,从一维到三维的可控修饰。利用互补的小尺寸金纳米颗粒作为可寻址探针,在透射电子显微镜下观察颗粒组装结构,以证明编码DNA分子的成功转移。此外,作者还利用荧光方法、动态光散射粒径测量方法、电泳进一步验证了该过程的高保真特点,以及数量和位置的可控性。本工作,结合DNA纳米技术和分子印迹策略,成功实现了金颗粒表面功能化DNA分子的数目和位置的可控修饰,在构建程序化组装结构用于光电器件,以及构建智能生物传感用于医学诊断等领域,展现了重大的应用潜力。
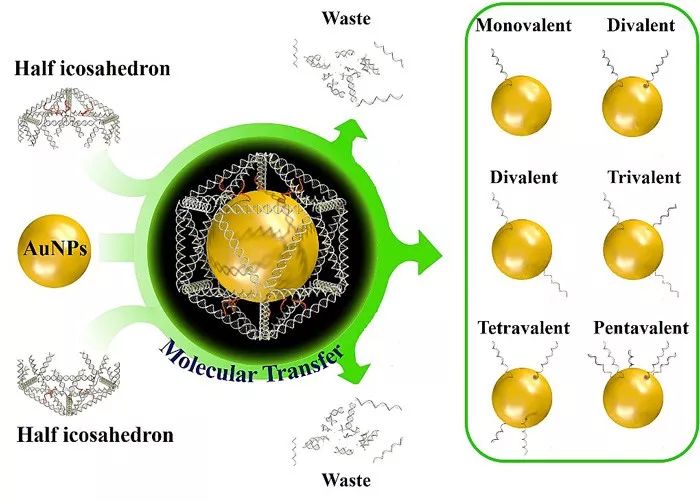
图1. 工作示意图。二巯醇修饰的红色模板链被嵌入在两个半二十面体内。两个半二十面体组成一个完整的二十面体并将金颗粒包被其中。待转移的编码DNA图案由嵌入在二十面体中不同位置的红色悬臂链组成,通过金巯键共价结合在金颗粒的表面。纳米笼被洗脱后,共价结合的DNA分子留在了金颗粒表面。根据这一原理可以设计不同的DNA编码图案,制备不同修饰数量和位置的DNA功能化金纳米颗粒。

图2. I-Cage的组装过程和表征。(A) DNA二十面体笼的合成过程。(B) 15%聚丙烯酰胺凝胶电泳表征5JMs的合成。Lane1-5: X1, X12, X123, X1234, 5JMs。(C) 10%聚丙烯酰胺凝胶电泳表征半二十面体。Lane1-5: X, Y, Z, XY5, XZ5。(D) 10%聚丙烯酰胺凝胶电泳表征I-Cage的合成。Lane1-3: XY5, XZ5, I-Cage。
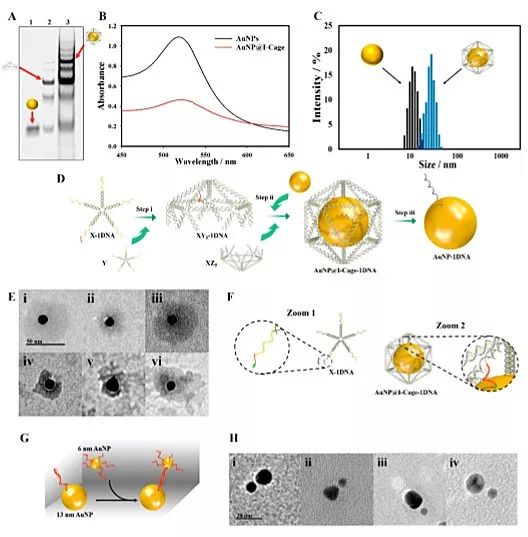
图3. (A) 0.8%的琼脂糖凝胶电泳验证金颗粒的包被过程。Lane1-3:BSPP处理的金颗粒,XY5+AuNPs,XY5+XZ5+ AuNPs。(B) 金颗粒包被前后的UV-vis图。(C) 金颗粒包被前后的DLS。(D) 分子转移过程。第一步将模板连组装在XY5和XZ5上;第二步通过将两个半二十面体组装的同时将金颗粒包被在I-Cage中;第三步去除I-Cage的模板。(E) AuNP@I-Cage的TEM图。(F)5JMX-DNA和I-Cage的细节图。(G)多价6 nm金颗粒探针和13 nm金颗粒组装示意图。(H) “大-小”金纳米颗粒二聚体结构的电镜表征图。
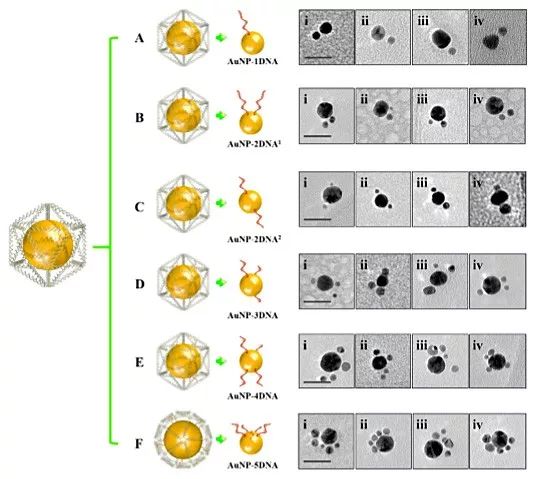
图4. 应用纳米笼分子转印策略制备的13 nm金颗粒与6 nm的金颗粒探针进行组装,在电镜下的成像图。
相关成果近期发表在ACS Nano (IF=13.709),第一作者为湖南大学化学化工学院博士生谢努力和硕士生刘世源,该研究工作得到了国家自然科学基金的资助。
该论文作者为:Nuli Xie, Shiyuan Liu, Hongmei Fang, Yanjing Yang, Ke Quan, Jing Li, Xiaohai Yang, Kemin Wang, Jin Huang
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657609537&idx=4&sn=4860047f29828a7113d738ae3adff7a6&chksm=80f7ce91b78047872299cce306d5394ae7c6a9546455c40ada8f7275b535355d979cf5f8a3a7&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

华裔女科学家实现天才的想法:发明全自动DNA分子机器人
靶向单个分子的DNA酶让基因“沉默”

木乃伊上能找到DNA分子吗? | 展卷

利用一种发卡DNA银纳米簇作为通用双输出信号生成器,“照亮”多样伴生DNA分子逻辑体系

中国微米纳米技术学会第十八届学术年会暨微系统与纳米工程高层论坛
DNA分子可变身自组装“接口”材料

DNA编码分子库为药物发明提供便利
第一届纳米纤维素材料国际研讨会在杭州召开



中国—奥地利纳米科技及新材料研讨和对接洽谈会在深圳举行




单链DNA编码“纳米”分子反应研究取得进展