科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-16
来源:BioArt
点评丨周翔(武汉大学教授)
责编丨黄蔚
表观遗传调控基因表达是分子生物学中心法则的拓展与延伸,是理解生命个体演化复杂性与多样性的重要前沿方向。近年来,以m6A-RNA甲基化修饰为代表的研究开辟了“表观转录组学”研究新方向。m6A是真核细胞中mRNAs丰度最高的甲基化修饰,影响了RNA生命周期的每个过程,如mRNA的稳定性、剪接及前体miRNA加工等,同时也参与了组织发育、干细胞修复分化、DNA损伤应答、生物节律调控和天然免疫调控等生物学过程【1】。m6A在细胞内的稳态由甲基转移酶复合体(METTL3, METTL14, WTAP和RBM15等)和去甲基化酶(FTO和ALKBH5)维持,而且m6A识别蛋白(YTHDF1/2和eIF3等)特异性识别m6A位点并将信息传递,由此构建了一套高效有序的m6A调控网络。m6A修饰失调与多种肿瘤发病、药物应答有着直接的关联,因此探索RNA上m6A修饰将有助于从表观转录的角度去解析生命科学的前沿问题、揭示表观转录紊乱导致的发病机制,为开发以m6A调节蛋白为靶点的新药提供新的切入点。
中科院上海药物研究所杨财广研究员带领化学生物学团队在国际上较早开展RNA去甲基化酶FTO的化学干预研究。他与上海药物所罗成研究员合作,报导了第一例FTO抑制剂【2】;与罗成研究员、北京大学贾桂芳教授合作,发现抗炎药甲氯芬那酸(Meclofenamic Acid,MA)选择性抑制FTO,而不抑制同源去甲基化酶ALKBH5【3】;与武汉大学周翔教授合作,发现荧光素类化合物是FTO去甲基化酶的双功能小分子探针【4】。这些(以及其他课题组报导的)FTO抑制剂,为m6A甲基化修饰以及FTO的生物学功能调控研究提供了小分子工具。然而,这些FTO抑制剂的活性和特异性相对较差,并且对它们的作用机制尚未完全研究清楚,因此,需要开发更有效的FTO抑制剂以应用于临床治疗。
2019年4月15日,杨财广课题组联合美国希望之城贝克曼研究所(City of Hope)陈建军教授团队以及佛罗里达大学钱志坚教授团队在Cancer Cell杂志发表研究 Small-Molecule Targeting of Oncogenic FTO Demethylase in Acute Myeloid Leukemia,该研究开发了两个新的FTO小分子抑制剂,FB23和FB23-2,它们直接结合FTO并特异性抑制FTO的m6A去甲基化酶活性,并抑制急性髓系白血病细胞的增殖,有望用于该病的临床治疗【5】。

2017年,陈建军教授团队发现FTO在急性髓系白血病部分亚型中显著高表达,诱导原癌基因介导的细胞转化引发白血病,并且抑制全反式维甲酸(ATRA)引起的急性髓系白血病细胞的分化(陈建军、何川组Cancer Cell报道肥胖基因FTO过表达导致白血病)【6】。在此工作基础上,最新的这项研究以白血病亚型中高表达的FTO为靶标,根据FTO识别甲基化RNA底物的分子机制等特点,基于结构导向的合理设计与药物化学构效关系研究,获得了两个FTO小分子抑制剂:FB23和FB23-2(FB23-2为FB2衍生物,细胞渗透率更高)(图1)。
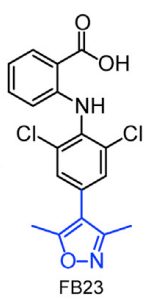
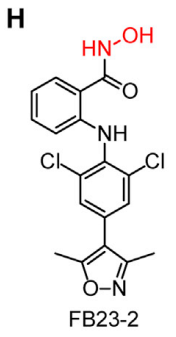
图1
为研究FB23和FB23-2对FTO的抑制活性及特异性结合能力,研究者检测了FB23对FTO的半最大抑制浓度(half maximal inhibitory concentration (IC50)),为0.06uM,这比已报道的FTO抑制剂MA的活性高140倍。同时,研究者检测和分析了FB23和FB23-2对RNA,DNA和组蛋白去甲基化酶及405个激酶蛋白的抑制效果,发现仅有6个激酶被抑制,但是IC50比FTO低50-220倍,说明FB23和FB23-2特异性结合并高效地抑制FTO活性。
进一步,研究者用FB23-2处理白血病细胞,发现FB23-2选择性抑制白血病细胞中FTO的m6A去甲基化酶功能,提高m6A的整体水平,同时上调白血病关键基因ASB2、RARA、MYC以及CEBPA等mRNA甲基化修饰的丰度,增加抑癌蛋白质的丰度,降低促癌蛋白质丰度,从而抑制实验室细胞系以及病人来源的原代白血病细胞增殖,并且在PDX(patient-derived xeno-transplantation)小鼠模型上展现明确的抗白血病治疗效果(图2)。
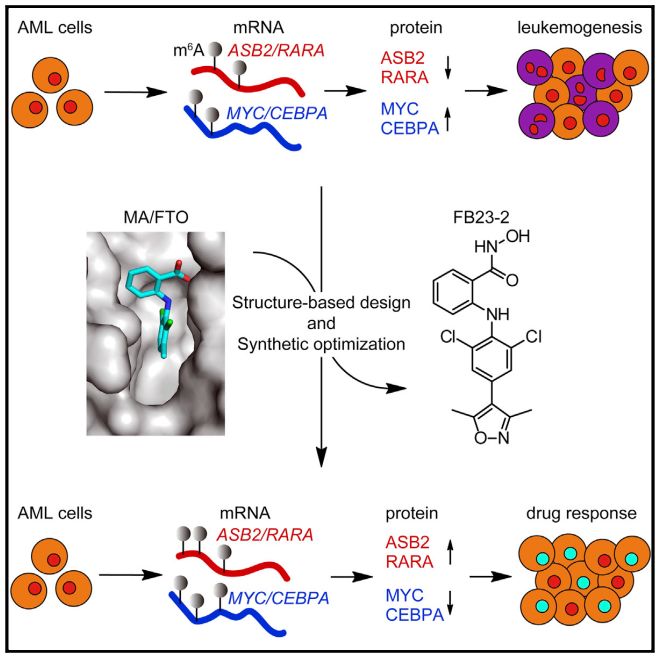
图2
该项研究是化学干预RNA甲基化修饰的重要新进展,实现了FTO抑制剂在抗急性髓系白血病研究上的初步探索。
同时,值得注意的是,FTO是最具争议的m6A催化相关蛋白。康奈尔大学的Samie R. Jaffrey教授和芝加哥大学的何川教授对FTO真正的催化底物是什么这个科学问题,有多次交锋。
2011年,何川教授在Nature Chemical Biology发表研究,N6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO,首次证明FTO是RNA m6A修饰的去甲基化酶。也是基于此研究,陈建军教授与何川教授合作在Cancer Cell发表FTO通过介导m6A去甲基化参与白血病进程的研究。
而2017年1月Samie R. Jaffrey教授在Nature发表研究 Reversible methylation of m6Am in the 5′ cap controls mRNA stability,颠覆FTO作为m6A去甲基化酶理论,认为FTO真正的作用底物是m6Am。
何川和陈建军教授也马上行动,同年12月发表研究R-2HG Exhibits Anti-tumor Activity by Targeting FTO/m6A/MYC/CEBPA Signaling,证明在白血病中,FTO虽然也具有一定的m6Am去甲基化酶活性,但考虑到m6Am的整体丰度远低于m6A,并且m6A对FTO的响应更明显,因此认为FTO在白血病中通过调控m6A,而非m6Am发挥作用。
并且,2018年9月,何川教授发现FTO在不同细胞中的分布不同,细胞核中的FTO介导m6A去甲基化,而细胞质中的FTO介导m6A和m6Am的去甲基化。
而今年1月,东京大学的Tsutomu Suzuki教授在SCIENCE发表研究 Cap-specific terminal N6-methylation of RNA by an RNA polymerase II–associated methyltransferase,首次鉴定了m6Am甲基化酶CAPAM,并称未发现FTO对m6Am有抑制作用。该研究从侧面支持了何川教授的观点。
今年2月,北京大学化学与分子工程学院贾桂芳与上海交通大学医学院张良课题组在PNAS在线发表了题为 Structural insights into FTO’s catalytic mechanism for the demethylation of multiple RNA substrates 的研究论文。该研究工作阐明FTO对不同RNA底物的催化机理,为深入研究FTO生理功能及开发FTO小分子抑制剂/激活剂奠定了基础。(PNAS丨贾桂芳/张良合作组揭示m6A去甲基酶FTO对底物的作用机制)
巧合的是,今年2月,Samie R. Jaffrey教授突然改口,认为mRNA上的m6A和m6Am对FTO的响应都不高,FTO的作用底物很可能是其他类型的RNA分子。在发表于Nature Chemical Biology的研究FTO controls reversible m6Am RNA methylation during snRNA biogenesis中,Samie R. Jaffrey教授认为FTO的真正作用底物是snRNA。
回到今天这篇文章,研究者确实在FB23-2处理细胞后,检测了m6Am的情况,mRNA上m6Am有所上升,但m6Am整体丰度太低,研究者依然认为FB23-2的抗癌效果来自对m6A的抑制。而关于snRNA上的m6Am是否也受FB23-2调控,尚未见报道。
靶向DNA和组蛋白修饰的药物已进入临床治疗,而基于RNA表观遗传学的肿瘤靶向治疗才刚刚开始。但同时我们也应该意识到,只有深入地完全地了解FTO的作用机制,才能为新药研发提供可靠的理论依据。
专家点评

周翔(武汉大学化学与分子科学学院教授、院长、教育部“长江学者”)
生物大分子的化学修饰是生命过程中一种普遍存在的调控方式,其重要的生理价值和病理意义已得到了人们的广泛认同和重视。这一领域已成为当前生命科学最受关注的前沿领域之一,也是化学与生命科学和医学交叉界面上最为活跃的研究前沿,并极大地促进了生命科学自身的发展,如表观遗传学的兴起。在RNA甲基化修饰方面,芝加哥大学何川教授于2010年提出了“RNA表观遗传学”的猜想,证明RNA分子同样受到动态甲基化修饰的调控,并直接影响基因转录和细胞命运的决定。经过短短几年的迅速发展,以m6A为代表的可逆、动态RNA甲基化修饰的生物学功能解析直接促成了表观转录组学这一新学科方向的诞生。
然而与表观遗传学相比,RNA甲基化修饰的人为操控和干预能力低,干预分子缺乏,滞后于生物学研究。作为RNA去甲基化酶,FTO除了通过氧化机制降低RNA甲基化修饰,此外还参与了复杂的蛋白质相互作用调控网络。因此基因干扰技术难以实现FTO某一具体功能的选择性干预。具有实时、可逆、选择性等特点的化学探针是研究RNA甲基化修饰及其相关蛋白质功能的可靠工具,同时将对深入理解由FTO去甲基化功能紊乱而导致的病理及其靶向性药物发现产生深远影响。
上海药物所在国际上较早开展FTO小分子抑制剂的研究,并且持续性地取得重要进展。借助外源小分子干预RNA甲基化修饰,对于进一步认识RNA生物学具有重要意义,有望揭示新的生命过程和发现新的疾病诊疗手段,也为后续新药发现奠定基础,具有重要的科学意义和社会价值。
制版人:珂
参考文献
1. Roundtree, I. A.; Evans, M. E.; Pan, T.; He, C., Dynamic RNA Modifications in Gene Expression Regulation. Cell 2017, 169 (7), 1187-1200.
2. Chen, B.; Ye, F.; Yu, L.; Jia, G.; Huang, X.; Zhang, X.; Peng, S.; Chen, K.; Wang, M.; Gong, S.; Zhang, R.; Yin, J.; Li, H.; Yang, Y.; Liu, H.; Zhang, J.; Zhang, H.; Zhang, A.; Jiang, H.; Luo, C.; Yang, C.-G., Development of cell-active N6-methyladenosine RNA demethylase FTO inhibitor. Journal of the American Chemical Society 2012, 134 (43), 17963-17971
3. Huang, Y.; Yan, J.; Li, Q.; Li, J.; Gong, S.; Zhou, H.; Gan, J.; Jiang, H.; Jia, G. F.; Luo, C.; Yang, C.-G., Meclofenamic acid selectively inhibits FTO demethylation of m6A over ALKBH5. Nucleic Acids Research 2015, 43 (1), 373-384
4. Wang, T.; Hong, T.; Huang, Y.; Su, H.; Wu, F.; Chen, Y.; Wei, L.; Huang, W.; Hua, X.; Xia, Y.; Xu, J.; Gan, J.; Yuan, B.; Feng, Y.; Zhang, X.; Yang, C.-G.; Zhou, X., Fluorescein Derivatives as Bifunctional Molecules for the Simultaneous Inhibiting and Labeling of FTO Protein. Journal of the American Chemical Society 2015, 137 (43), 13736-13739
5. Huang, Y.; Su, R.; Sheng, Y.; Dong, L.; Dong, Z.; Xu, H.; Ni, T.; Zhang, Z. S.; Zhang, T.; Li, C.; Han, L.; Zhu, Z.; Lian, F.; Wei, J.; Deng, Q.; Wang, Y.; Wunderlich, M.; Gao, Z.; Pan, G.; Zhong, D.; Zhou, H.; Zhang, N.; Gan, J.; Jiang, H.; Mulloy, J. C.; Qian, Z.; Chen, J.; Yang, C.-G., Small-molecule targeting of oncogenic FTO demethylase in acute myeloid leukemia. Cancer Cell 2019, 35 (4), 677-691
6. Li, Z.; Weng, H.; Su, R.; Weng, X.; Zuo, Z.; Li, C.; Huang, H.; Nachtergaele, S.; Dong, L.; Hu, C.; Qin, X.; Tang, L.; Wang, Y.; Hong, G. M.; Huang, H.; Wang, X.; Chen, P.; Gurbuxani, S.; Arnovitz, S.; Li, Y.; Li, S.; Strong, J.; Neilly, M. B.; Larson, R. A.; Jiang, X.; Zhang, P.; Jin, J.; He, C.; Chen, J., FTO Plays an Oncogenic Role in Acute Myeloid Leukemia as a N(6)-Methyladenosine RNA Demethylase. Cancer Cell 2017, 31 (1), 127-141
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468797&idx=1&sn=15060e0557e4882e43f3112e726e3e7f&chksm=84e2e589b3956c9f8f2bd88870e3364d748fe7eae6bea60d5edc93e33e654da6344ab4a11259&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
氰甲基化

路超团队等揭示H3K36甲基化修饰与DNA甲基化修饰之间调控的内在机理
研究揭示成瘾行为形成DNA去甲基化调控机制
中国抗癌协会整合肿瘤学分会成立大会在西安召开




超强甲基化,此中有真意:一种新型甲基化试剂问世
氯甲基化反应
Eschemoser亚甲基化反应

揭示小RNA介导DNA甲基化调控水稻分蘖分子机制

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
澳大利亚icon医疗集团访问中国抗癌协会秘书处

