科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-16
来源:BioArt
责编 | 兮
在大多数真核生物中,线粒体是最不寻常的重要细胞器。线粒体融合和分裂的动态平衡是一种对生命至关重要的严格调节过程。细胞骨架不仅在维持细胞形态,承受外力、保持细胞内部结构的有序性方面起重要作用,而且还参与许多重要的细胞过程,包括肌肉收缩、细胞运动、细胞分裂和胞质分裂,囊泡和细胞器运动,细胞信号传导以及细胞连接。
近年一些研究,包括两篇发表在Science的重要文章【1,2】表明内质网和肌动蛋白参与线粒体分裂。肌动蛋白细胞骨架可以通过将线粒体直径缩小到适合分裂的大小来正向调节线粒体分裂,然而,尚不清楚肌动蛋白细胞骨架如何促进线粒体收缩的。这些基于荧光显微镜的研究提出的各种模型难以合理地解释由依赖肌动蛋白的动力产生系统的尺寸所施加的几何约束。内质网和肌动蛋白这两个关键因素是如何驱动线粒体分裂的具体机制仍然是个谜,其中最关键的原因是缺乏在线粒体收缩和分裂部位直接精细的细胞骨架超微结构信息。
在半个世纪之前,线粒体和内质网的超微结构已经被用电子显微镜技术观察到,近几年快速发展的超分辨率荧光显微镜也可以观察到它们的精细结构,但到目前为止,肌动蛋白细胞骨架的单丝分辨率只能通过电子显微镜才能实现。在各种电子显微镜方法中,只有少数可以适当地保存和分辨单个肌动蛋白丝。其中以二十年前研发并不断完善的铂复型电子显微镜(PREM)技术在观察样品的三维超微结构方面特别有效,,因而成功地解决了细胞骨架领域诸多问题。但是这种技术需要先用洗涤剂溶解细胞质膜以暴露其细胞骨架,同时也破坏了包括线粒体和内质网在内的膜细胞器的结构。
为了解决同时揭示细胞骨架和膜细胞器的超微结构这个难题,宾西法尼亚大学的 Changsong Yang (杨长松)和Tatyana M.Svitkina 博士在试验了很多方法后,最后地发现了两种互补化学物理的方法(温和的洗涤剂皂苷或轻微附着的硝酸纤维素膜)可以使细胞质膜顶端表面产生开口,通过这些开口可以看到具有膜细胞器细胞骨架的几乎完整的细胞内部。这种新方法与铂复型电子显微镜有机结合使我们第一次成功地同时观察到了线粒体、内质网以及个单丝肌动蛋白等细胞骨架的超微结构。
2019年4月15日,Yang和 Svitkina 在 Nature Cell Biology在线发表题为 Ultrastructure and dynamics of actin-myosin II cytoskeleton during mitochondrial fission的文章,报导了在线粒体收缩和分裂部位细胞骨架超微结构,以及相关的时空动态变化,继而提出了一种全新的细胞骨架介导的线粒体收缩机制模型。

本文章通过利用一系列铂复型电子显微镜,关联荧光显微镜和电子显微镜(CLEM),免疫电镜,并结合其它分子细胞生物学技术,对三种细胞在正常培养,抑制或刺激线粒体分裂等条件下线粒体、内质网、丝状肌动蛋白以及非肌肉肌球蛋白II之间的相互关系进行了深度详细地分析。研究结果表明,细胞中的线粒体被包围在含有大量无支链肌动蛋白丝的细胞骨架网络中。自发和诱导的线粒体收缩通常与包含该间质网络的一部分纵向肌动蛋白丝的纵横交错排列相关联。非肌肉肌球蛋白II与线粒体相邻,在收缩部位没有特异性富集。在离子霉素诱导的线粒体裂变期间,丝状肌动蛋白云与线粒体收缩位点共定位,而非肌肉肌球蛋白II云主要在附近波动。
本研究基于单个细丝的分辨率的超微结构获得的数据不支持目前流行的基于荧光显微镜的研究提出的推动或收缩环模型。因此,研究人员认为肌球蛋白II的收缩活动导致纵横交错排列的肌动蛋白丝网络的随机不均匀变形将压力施加到线粒体表面上从而启动完成线粒体收缩的曲率感测机制,最终完成线粒体分裂过程。有趣的是,肌球蛋白II可以从远处拉动与线粒体相交的肌动蛋白丝的过程可以与拉紧紧身胸衣绳以引起腰围收缩的方式相类比。
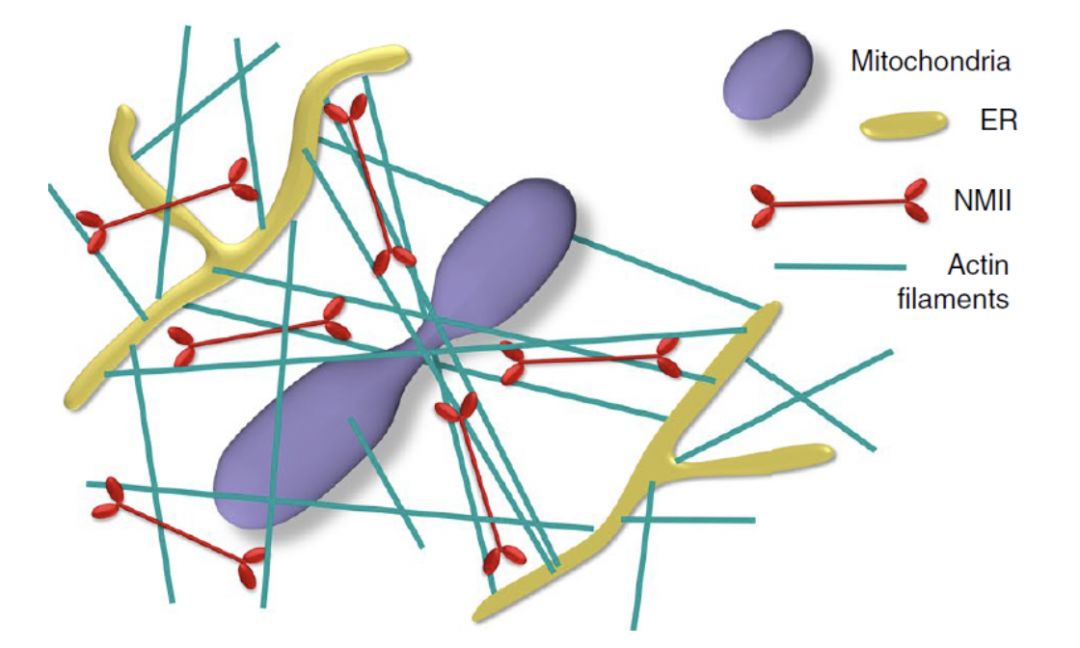
总之,本研究不仅为内质网和肌动蛋白和肌球蛋白介导的线粒体分裂过程提供了新的见解,而且为该研究开发的方法还为未来的研究提供了框架,也为其它许多细胞生物学领域比如细胞器动力学和细胞骨架功能之间的相互作用的后续研究打下了基础。
原文链接:
https://doi.org/10.1038/s41556-019-0313-6
制版人:子阳
参考文献
1. Friedman, J. R. et al. ER tubules mark sites of mitochondrial division. Science 334, 358-362, doi:10.1126/science.1207385 (2011).
2. Korobova, F., Ramabhadran, V. & Higgs, H. N.An actin-dependent step in mitochondrial fission mediated by the ER-associatedformin INF2. Science 339, 464-467,doi:10.1126/science.1228360 (2013).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468797&idx=3&sn=18d4cc9c3432ab4d6b5dfa2cfa4570d8&chksm=84e2e589b3956c9fae41ad65633a909d3a0c40ddda56299c4c24862b3c76a1ca218507f038ea&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

电子显微镜分辨率突破了世界纪录

中文解读 | 脑出血后铁毒性、脂质过氧化和铁死亡

扫描电镜“弱视”,工业制造难以明察秋毫

电子显微镜下的可怕世界,完全颠覆了你的想象力

北方是家鸡的驯化中心?线粒体DNA分析不支持
研究前沿:Nature-全细胞和组织的开放式体积电子显微镜图谱
【纳米】Angew. Chem.:纳米酶催化级联反应仿生模拟线粒体氧化磷酸化
扫描电子显微镜检查
线粒体也能来自父亲

原位透射电子显微镜在能源材料和器件中的应用