科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-17
来源:X一MOL资讯
原标题:【有机】四川大学王天利课题组Angew. Chem.:首次实现季鏻盐催化的四取代氮杂环丙烷不对称合成
氮杂环丙烷结构广泛存在于天然产物和手性医药分子之中,近年来手性氮杂环丙烷衍生物的高选择性合成受到化学家们关注。Wulff和Maruoka等研究小组发展了布朗斯特酸催化亚胺和α-重氮酸酯的环化反应实现了二取代氮杂环丙烷分子的高效构建 (J. Am. Chem. Soc., 2009, 131, 15615; J. Am. Chem. Soc., 2008, 130, 14380;J. Am. Chem. Soc., 2011, 133, 9730)。然而,三取代氮杂环丙烷化合物的不对称合成例子却很少 (K. Maruoka*, J. Am. Chem. Soc., 2011, 133, 9730; B. M. Trost*, Angew. Chem. Int. Ed., 2017, 56, 2440);而四取代的氮杂环丙烷衍生物的不对称合成例子至今未见报道,依然是不对称合成化学研究的挑战之一。
四川大学化学学院的青年千人王天利教授课题组致力于发展新型手性季鏻盐及相关催化体系和不对称合成新方法学。基于上述研究背景,该课题组利用天然氨基酸衍生的柔性骨架-双功能手性季鏻盐催化剂,首次实现了四取代氮杂环丙烷衍生物的高效高选择性不对称合成,该催化方法同样适用于二取代和三取代氮杂环丙烷的高效不对称合成(图1)。
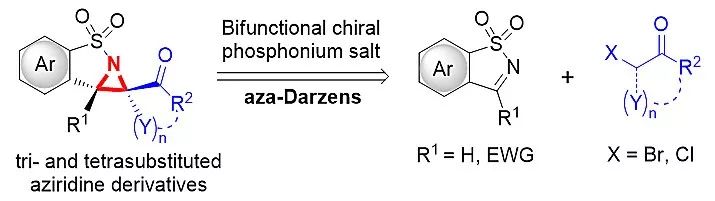
图1. 手性季鏻盐催化不对称合成四取代氮杂环丙烷衍生物
经过一系列条筛选,作者发现以手性二肽季鏻盐P为催化剂和K3PO4·7H2O (4.0 equiv.) 为碱,成功实现了环状亚胺和α-卤代酮的aza-Darzens反应,并以93% yield和>99% ee获得氮杂环丙烷产物 (3a)。在最优条件下,作者首先尝试了三取代和二取代氮杂环丙烷化合物的不对称合成,并考察了底物的普适性。他们发现在构建三取代和二取代环丙烷的反应中,亚胺底物上取代基电子效应和位阻效应对反应活性和立体选择性均没有影响。同时,一系列含有给电子基、吸电子取代基、多取代基、杂环取代基、以及稠芳环的α-卤代酮均能够参与反应并获得相应的多取代氮杂环丙烷产物(up to >99.9% ee)。
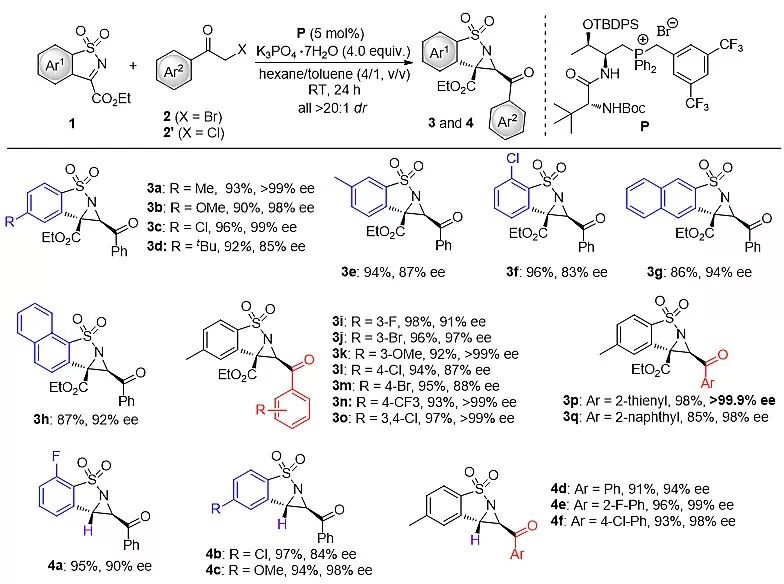
图2. 三取代和二取代氮杂环丙烷衍生物的不对称合成
作者在上述最优反应条件下,进一步研究了具有挑战性的四取代氮杂环丙烷的高效不对称合成,并考察了底物的普适性。他们发现一系列环状酮亚胺和各种结构的α-卤代酮都能参与该反应,生成相应的四取代氮杂环丙烷产物,并取得有优秀的产率和立体选择性(up to > 99.9% ee)。
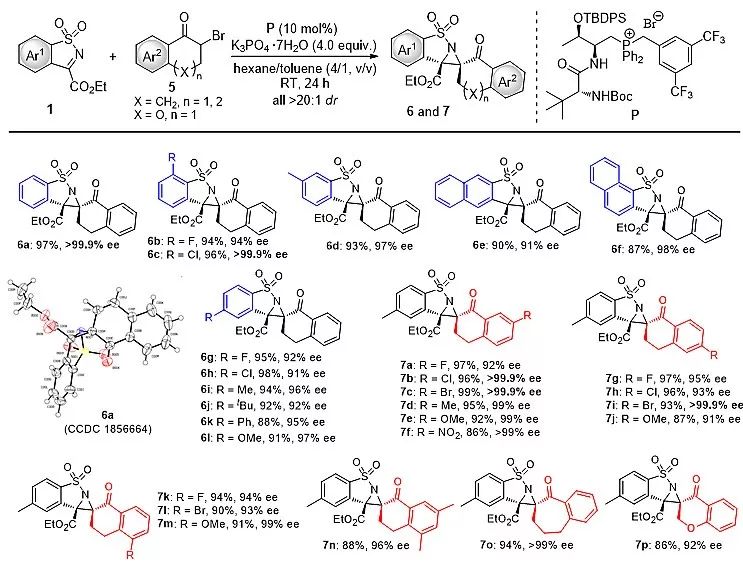
图3. 四取代氮杂环丙烷衍生物的不对称合成
随后,作者研究了克级规模反应和产物衍生合成,发现上述催化反应能够被放大到克级规模合成,其产率和对映选择性得到保持;基于上述催化方法,作者合成了具有潜在抑制HIV-1的活性手性化合物。此外,作者通过实验和DFT理论计算对该反应机理进行了研究,并发现催化剂与底物之间的双H-键作用是该反应手性诱导的本质(图4)。
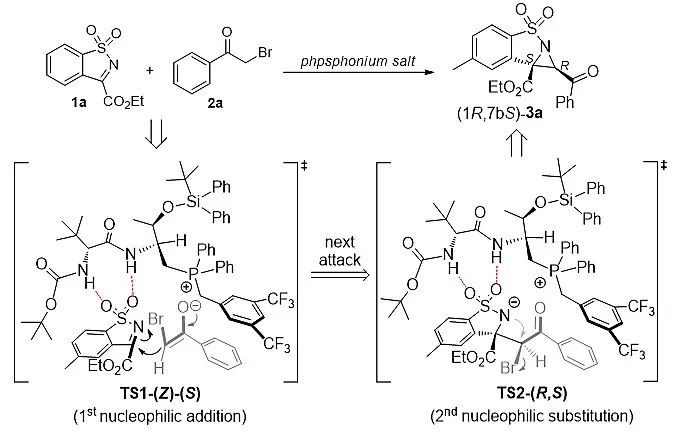
图4. 反应过渡态
综上,王天利教授团队利用氨基酸衍生的手性二肽-季鏻盐相转移催化aza-Darzens反应策略,首次实现了四取代氮杂环丙烷衍生物的高效高选择性合成,这一研究成果近期发表于Angew. Chem. Int. Ed.,四川大学化学学院2018级博士生潘建科和2018级硕士生吴佳鸿为共同一作。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657609743&idx=5&sn=0cd44040ee9fbd355b29b3b236d0b3bf&chksm=80f7c1dfb78048c9c363a151eab9d750c30dd12eb52d1b679a2c504edfb89b9760343cc57b00&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
(R)-环氧氯丙烷
2-溴-1-氯丙烷

范杰教授课题组:聚磷酸配体修饰调控氧化镍纳米颗粒在丙烷氧化脱氢反应中的选择性
1,2-二氨基-2-甲基丙烷

【催化】铂钴双金属纳米团簇催化剂的生长机制及其在丙烷脱氢中的应用

干货:自聚微孔聚合物在高耗能分离膜材料方面的应用研究进展!
七氟丙烷
2,2'-硫代二丙烷
1-溴-3-苯基丙烷
1,2-二溴六氟丙烷