科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-02
来源:BioArt
线粒体Ca2+在调节ATP的产生、细胞分裂以及细胞死亡方面发挥着重要作用,线粒体的Ca2+摄取由位于线粒体内膜上的线粒体钙单向转运体(mitochondrial Ca2+uniporter, MCU)完成。2011年该复合物被鉴定以来,围绕该复合物的研究异常火热。完整的高等真核生物的线粒体钙单向转运体主要由四个亚基组成,包括核心亚基MCU、EMRE以及辅助亚基MICU1、MICU2,低钙下,MICU1/MICU2抑制Ca2+通过MCU进入线粒体,高钙下MICU1/MICU2促进MCU的Ca2+转运。结构生物学家争先求索,由组成比较简单的真菌复合物入手,逐渐深入到复杂的人源复合物,从结构生物学的角度揭示了MCU领域的许多重大问题,尤其解释了低Ca2+下MICU1/MICU2如何抑制Ca2+通过MCU进入线粒体,相关文章发表在Nature、Cell、Science和Elife等杂志上【1-6】。然而悬而未决的问题是:高Ca2+下MICU1/MICU2如何实现对MCU的激活?EMRE为什么是高等真核生物必需的?
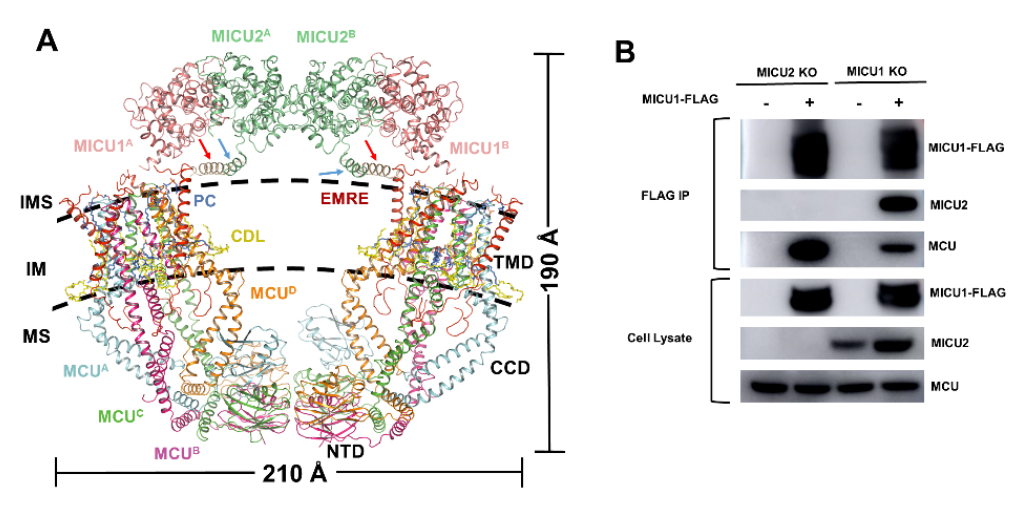 图1 完整的MCU-EMRE-MICU1-MICU2结构和验证
图1 完整的MCU-EMRE-MICU1-MICU2结构和验证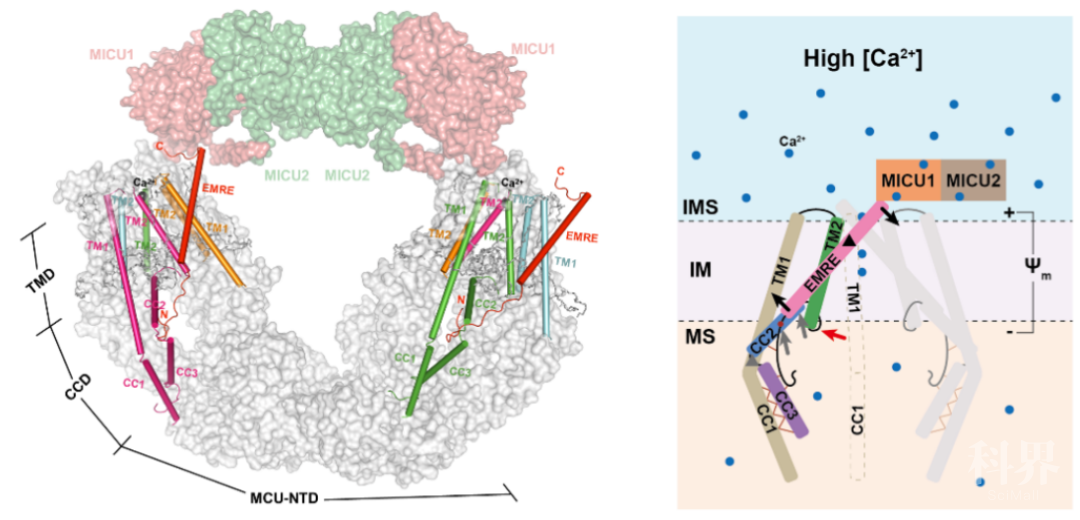 图2 EMRE通过杠杆机制介导MICU1/MICU2调节Ca2+转运模型
图2 EMRE通过杠杆机制介导MICU1/MICU2调节Ca2+转运模型参考文献
Fan, M., Zhang, J., Tsai, C.-W., Orlando, B. J., Rodriguez, M., Xu, Y., Liao, M., Tsai, M.-F., Feng, L. Structure and mechanism of the mitochondrial Ca2+ uniporter holocomplex. Nature. 2020 Jun;582(7810):129-133.
Wang, Y., Nguyen, N. X., She, J., Zeng, W., Yang, Y., Bai, X.-C., Jiang, Y. Structural mechanism of EMRE-dependent gating of the human mitochondrial calcium uniporter. Cell. 2019 May 16;177(5):1252-1261.Fan, C., Fan, M., Orlando, B. J., Fastman, N. M., Zhang, J., Xu, Y., Chambers, M. G., Xu, X., Perry, K., Liao, M., Feng, L. X-ray and cryo-EM structures of the mitochondrial calcium uniporter. Nature. 2018 Jul;559(7715):575-579.Baradaran, R., Wang, C., Siliciano, A. F. & Long, S. B. Cryo-EM structures of fungal and metazoan mitochondrial calcium uniporters. Nature. 2018 Jul;559(7715):580-584.Nguyen, N. X., Armache, J. P., Lee, C., Yang, Y., Zeng, W., Mootha, V. K., Cheng, Y., Bai, X.-C., Jiang, Y. Cryo-EM structure of a fungal mitochondrial calcium uniporter. Nature. 2018 Jul;559(7715):570-574.Yoo, J., Wu, M., Yin, Y., Herzik, M. A. Jr, Lander, G. C., Lee, S.-Y. Cryo-EM structure of a mitochondrial calcium uniporter. Science. 2018 Aug 3;361(6401):506-511.来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652497879&idx=4&sn=09df34baf8c5c91f7eeae7e918f4dd2d&chksm=84e27463b395fd758f703fdb07828c47668d428a09e5b8bcedd3768c718c75952c2f5baad719&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科学家揭示线粒体钙离子单向转运蛋白MCU的结构机制

活动预告丨“CAAI进校园”系列活动走进电子科技大学

恭喜!比亚迪半导体:车规MCU,出货超1000万颗!
Cell:肺病为什么咳嗽?
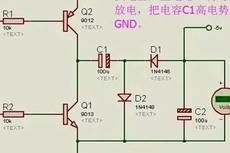
如何利用MCU的PWM产生负电压
MCU-32分布式模块化自动测量系统

Cell Stem Cell:皮肤是突变的战场?

安全MCU支撑物联网快速发展
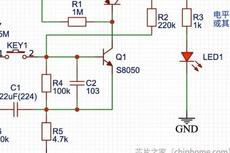
无MCU实现按键电平保持的电路,手把手带你精准分析电流走向

半导体MCU产业研究:缺货潮加快国产替代,本土厂商迎机遇