科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-25
来源:iNature
在保守的自噬途径中,自噬体(AP)吞噬细胞组分并将它们递送至溶酶体以进行降解。在与溶酶体融合之前,AP必须通过未知机制关闭。2019年4月22日,南京农业大学生命科学学院梁永恒教授团队在Journal of Cell Biology上发表了题为“Rab5-dependent autophagosomeclosure by ESCRT”的研究论文。文章揭示了一种机制,其中Rab5依赖性Atg 17-Snf 7相互作用导致ESCRT的募集以打开APs,其中ESCRT催化APs关闭。

自噬是一种循环途径,可以在正常和压力条件下使多余的和受损的细胞成分在溶酶体中降解。该途径中的缺陷与无数的人类疾病有关。尽管大自噬由自噬相关蛋白(Atgs)和与溶酶体融合的双膜自噬体(APs)介导,但在微自噬中,货物被溶酶体膜直接吞噬。大多数关于宏观自噬的研究都集中在它的开始,包括诱导它的信号通路,它们对Atgs的影响,以及Atgs对自噬前体结构的组装。早期自噬步骤的理解起源于酵母中的研究,后来证实机械和机制是高度保守的。
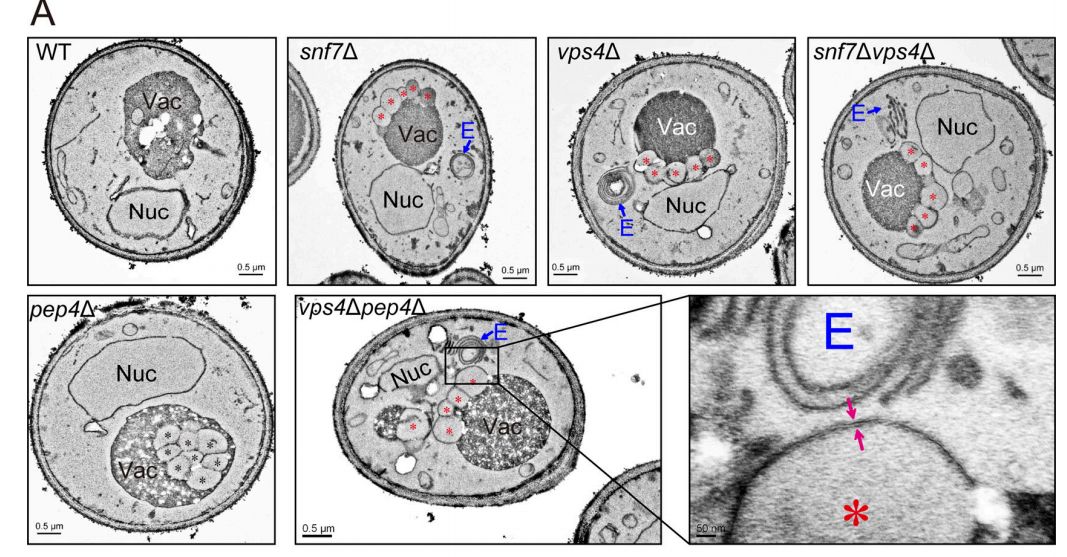
在ESCRT突变细胞中积累的膜结构的超微结构分析
以前的研究已经表明内吞Rab5-GTP酶调节AP闭合。因此,研究人员询问是否ESCRT催化囊泡切割成晚期内体,是否介导拓扑相似的AP密封过程。在这里,研究人员显示来自所有ESCRT复合物的代表性亚基的耗尽导致晚期自噬缺陷和AP的积累。关注两个亚基,研究人员显示Snf7和Vps4 ATP酶定位于AP,它们的耗尽导致开放AP的积累。
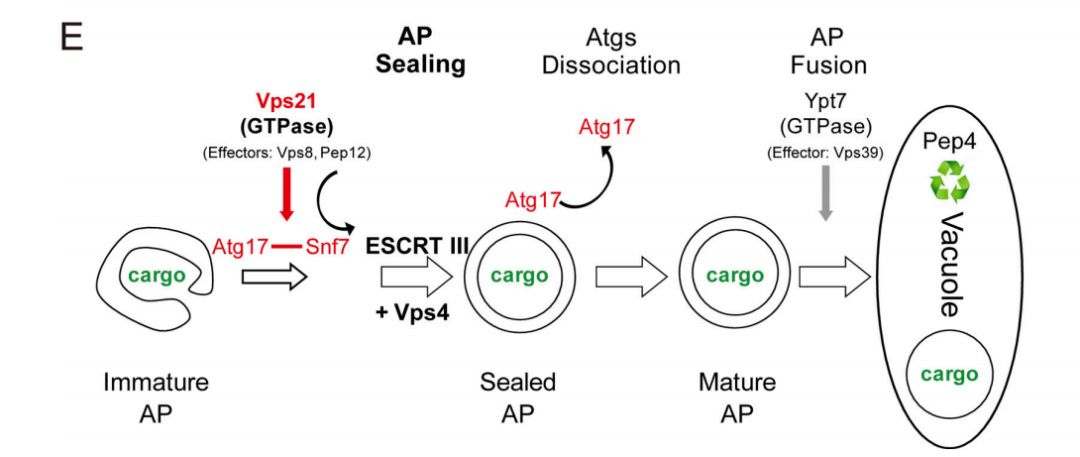
Rab5 GTP酶调节和ESCRT III催化的AP闭合图
此外,Snf7和Vps4蛋白在体内和体外补充其相应的突变缺陷。最后,Rab5控制的Atg17-Snf7相互作用对于Snf7定位到AP是重要的。因此,研究人员揭示了一种机制,其中Rab5依赖性Atg 17-Snf 7相互作用导致ESCRT的募集以打开APs,其中ESCRT催化APs关闭。
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247500594&idx=6&sn=b5c60d9bb669222e3da51f976f34af6e&chksm=fce6b0edcb9139fb8c829c33fe3fe19cf90db240e92b986ac80143df94f768bdc988cd07da68&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
邵峰组破解细菌感染介导自噬的机制,为选择性自噬通路的研究提供新思路




Dev Cell:阻断细胞自噬可用于治疗癌症
自噬诱导基因ULK1/ULK2独立于自噬的功能——调控应激颗粒解聚

细胞自噬关键蛋白突变可延寿

潘李锋团队新进展:自噬SNARE蛋白Syntaxin17介导自噬体-溶酶体融合

蠕虫自噬肠道致衰老
揭示铵胁迫下的自噬通量调节
中科院科学家在线粒体自噬过程探针和干预自噬过程策略研究中获进展
Cell细读 | 突破,自噬领域重大发现,磷脂合成途径是自噬体的膜磷脂来源

昆明动物所等在百岁老人健康长寿保护机制研究中取得进展----中国科学院