科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-04
来源:X一MOL资讯
π-共轭高分子在生物医用领域潜力巨大。其中,具有生物粘附性能的聚多巴胺(PDA)由于其独特的分级结构,在二维(2D)材料的构筑上(温和的合成条件:弱碱环境、室温)具有很大的潜力。然而在聚合过程中,如何引导PDA的一级结构在一定的空间取向上定向排列,从而实现PDA纳米材料形貌的精确控制仍然是一个挑战。根据之前报道的文献,DNA碱基对平面(~3.4 Å)和PDA一级结构平面(~3.6 Å)的层间距之间具有相似性。
受此启发,重庆大学张吉喜团队利用DNA和PDA一级结构之间的结构互补特性,通过溶液内超分子相互作用首次合成了自支撑DNA-PDA纳米片。通过对纳米片的结构进行表征和分析,作者提出DNA-PDA纳米片是以DNA作为结构导向剂,通过PDA一级结构的纵向交错嵌插(与DNA的碱基对平面)和横向π-π堆积组装形成的二维片状结构(图1)。
图1. DNA-PDA纳米片的形成示意图。
研究表明,合成体系中DNA浓度极低时(鲱鱼精DNA/盐酸多巴胺的质量比为0.025:1),得到的纳米片呈圆盘状,尺寸在100-200 nm之间,厚度约25 nm。高分辨透射电子显微镜(HRTEM)观察发现,纳米片上呈现2类晶格间距(2倍关系),即中间区域呈0.18 nm,而边缘区域则呈0.36 nm。另外透射电子显微镜(TEM)观察和元素扫描、X射线衍射图谱(XRD)、拉曼光谱和傅里叶转换-离子回旋共振质谱(FT-ICRMS)数据,这些对纳米片结构和组成的多方表征均验证了作者对DNA-PDA纳米片形成机制的理论假设(图2)。
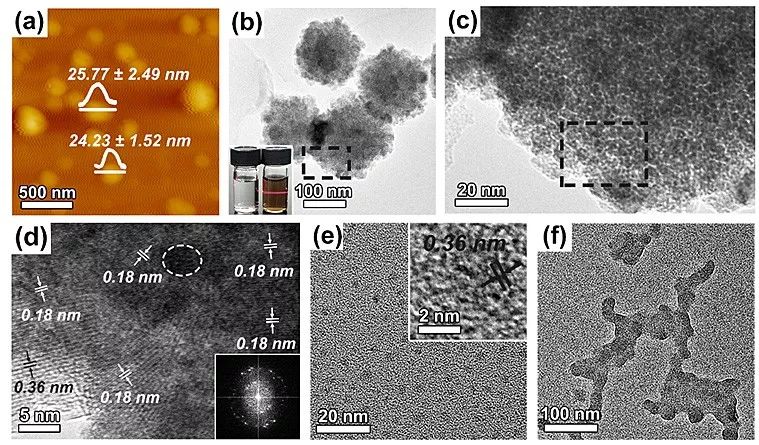
图2. DNA-PDA纳米片的材料表征。图片来源:Nanoscale Horiz.
DNA碱基对平面间距比PDA一级结构间距小0.2 Å,因此,这两者之间沿DNA轴向(~17 nm)的交错嵌插有可能在一定距离以后发生错配。因此,作者以较高的DNA浓度(鲱鱼精DNA/盐酸多巴胺质量比为0.125:1到2:1)或者较大的DNA链长来弥补DNA和PDA横向堆积过程中的错配效应。研究发现,随着DNA浓度的增加,纳米片的横向尺寸从纳米尺度增加至微米尺度,厚度呈先下降再上升的趋势,并且纳米片表面的粗糙度越来越大。另一方面,如果将合成过程中的结构导向剂替换成长链DNA,那么无论DNA浓度大或小,均无法得到微米尺度的薄片(图3)。
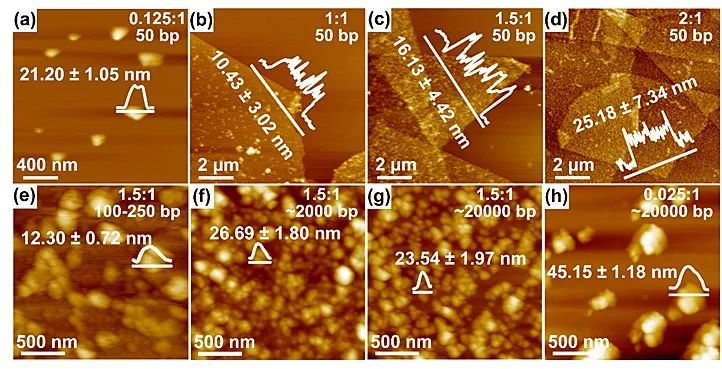
图3. 调节DNA浓度和链长控制纳米片形貌。图片来源:Nanoscale Horiz.
DNA-PDA纳米片借助π-π堆积和疏水作用能够吸附抗肿瘤药物阿霉素(DOX),并具有酸响应释放特性,是一种潜在的药物输送载体。此外,DNA-PDA纳米片具有卓越的光热转换性能,纳米级DNA-PDA片状结构的光热转换效率达到51%,而微米级DNA-PDA片状结构的光热转换效率高达86%,大尺寸纳米片光热转换效率的升高可能来自于横向堆积范围增大对光热转换过程中电子转移的影响。纳米片的光热性能可以进一步促进DOX在酸性环境中的释放,并实现光热-化学治疗对肿瘤细胞(MCF-7/ADR)的协同抑制作用。
该体系利用DNA和PDA之间的结构匹配特性,首次合成了DNA-PDA二维纳米结构并对其形成机理、结构调控、光热转换能力以及抗肿瘤性能进行了系统研究和评价。为π-共轭高分子材料的纳米结构控制和自组装研究、复杂有序二维纳米材料的设计及其肿瘤治疗应用提供了新的思路。该研究受国家自然科学基金资助,近期发表于Nanoscale Horizons 杂志。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657610875&idx=7&sn=1f7bef281ff20f159eec481954d9097d&chksm=80f7c5abb7804cbdfec4468f12141f01845e2cb0f7b34a188947b01d47b59b42e6327bb6135a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
二维材料半导体量子晶体管研究取得新进展 实现有效电学调控
中国—奥地利纳米科技及新材料研讨和对接洽谈会在深圳举行




研究透视:Nat Rev Phys二维材料的纳米级磁场成像
宁波材料所在二维纳米防护薄膜材料方面取得进展
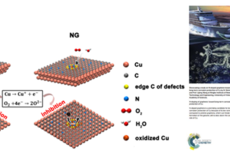
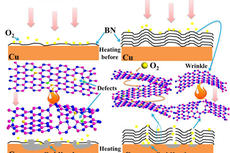
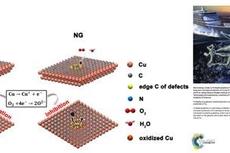
宁波材料所在二维纳米防护薄膜材料方面取得进展

中国微米纳米技术学会第十八届学术年会暨微系统与纳米工程高层论坛
演化:“最奇怪动物”身份揭秘

未来将属于二维材料时代 | “石墨烯之父”海姆讲述二维材料发展

Nat Rev Phys二维材料的纳米级磁场成像
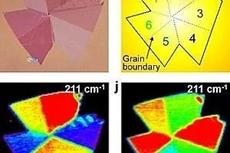
二维材料生长新模式:“纳米组装生长”