科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-05
来源:科学通报
周环反应是一类不同于离子反应和自由基反应的通过环状过渡态进行的协同反应, 如经典的Diels-Alder反应([4+2]环加成)、Cope-重排反应、Claisen-重排反应等, 可以高效构建碳-碳和碳-杂原子键, 在有机合成尤其是含有复杂多环骨架的天然产物的合成中有着广泛的应用。有意思的是, 在天然产物的生物合成研究中, 科学家经常推测通过周环反应途径实现相应的重要中间体或化合物的合成, 虽然酶在其中的作用毋庸置疑, 然而在过去的50多年里被发现和鉴定的可以催化周环反应的酶则仅有极少数几例[1~4]。例如, 2011年, 美国得克萨斯大学奥斯汀分校的刘鸿文课题组[1]在商用强效杀虫剂活性组分spinosyn A的生物合成机制研究中, 成功鉴定出能够催化Diels-Alder反应的环合酶SpnF, 首次证实了自然界中D-A酶的存在; 2017年, 加州大学洛杉矶分校的唐奕课题组及合作团队[4]在研究真菌次级代谢产物leporin B的生物合成过程中, 发现并鉴定了一种S-腺苷-L-蛋氨酸(SAM)依赖的多功能酶LepI, 能够催化分子内D-A反应、杂D-A反应和retro-Claisen重排。相对于D-A反应所涉及的6π环化过程, 更高阶的环加成反应, 比如[6+4]所涉及的10π环化反应是否也存在于生物合成过程中, 也即自然界中是否存在着可催化[6+4]环加成反应的酶仍然有待科学家去发现和证实。
近日, 南京大学谭仁祥、戈惠明、梁勇与加州大学洛杉矶分校的Kendall N. Houk课题组[5]合作, 在天然产物生物合成领域取得突破, 首次从生物合成途径中鉴定出微生物中能够催化[6+4]环加成反应的一类酶家族, 该成果于2019年3月13日在线发表在Nature上。
谭仁祥、戈惠明研究组在前期工作中, 从海洋对虾的肠道中分离得到了一株海洋放线菌Streptomyces seoulensis A01。通过活性介导的天然产物发现策略, 从该菌株的发酵液中分离到一个具有抗幽门螺旋杆菌活性的新颖大环内酯化合物streptoseomycin。研究人员根据其结构和基因信息推测在微生物体内的合成过程中可能涉及[4+2]环加成反应。比较streptoseomycin及其结构类似物nargenicin的生物合成基因簇, 他们发现其中一个未知功能的蛋白StmD与NgnD有85%的相似性, 进而推测它们可能分别负责催化streptoseomycin和nargenicin合成中的环加成步骤。为了验证这个猜想, 研究人员首先敲除了stmD基因, 实验结果显示仅能得到链状分子4和5(推测是环化产物前体3自发水解开环导致); 进一步敲除基因簇上大部分基因, 仅保留3个聚酮合成酶(PKS)基因, 发现只能得到化合物4; 而当缺失的stmD基因被重新补回时, 反应不仅给出了[6+4]环化产物6和8而且还得到了[4+2]环化产物7, 研究还发现化合物7很容易经[3,3]-Cope重排转化为6。这一系列研究结果表明, 聚酮合成酶仅能催化得到环化产物前体3, StmD的存在确实是催化发生[6+4]和[4+2]环加成反应的关键(图1)。
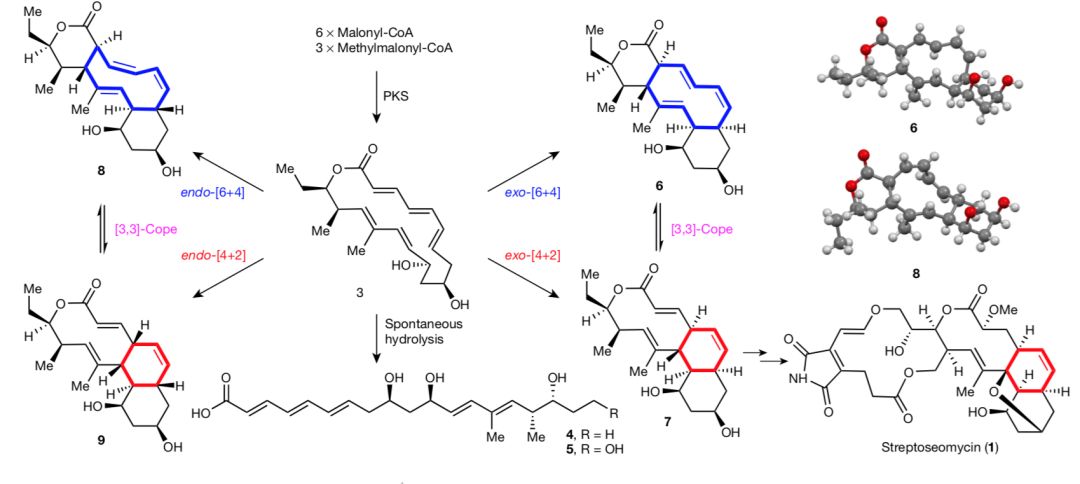
图1. Streptoseomycinsh生物合成中的环加成
为了验证周环酶的催化功能, 研究人员设计了两步串联的体外酶反应实验。首先通过聚酮合成酶上的硫酯酶结构域催化新合成的链状模拟底物得到环化产物前体3, 当进一步用StmD或NgnD催化时, 反应确实可以得到环加成产物6~8, 这说明StmD和NgnD都可以同时催化[4+2]和[6+4]反应。进一步的密度泛函理论(DFT)计算发现, 3在酶催化下可以经历不同的过渡态分别发生[6+4]和[4+2] 反应(图2(a), exo pathway; 图2(b), endo pathway), 其中[6+4]产物在热力学上更稳定, [4+2]产物7和9可经[3,3]-Cope重排转化成[6+4]产物。这些理论计算结果与之前观察到的实验结果相吻合。
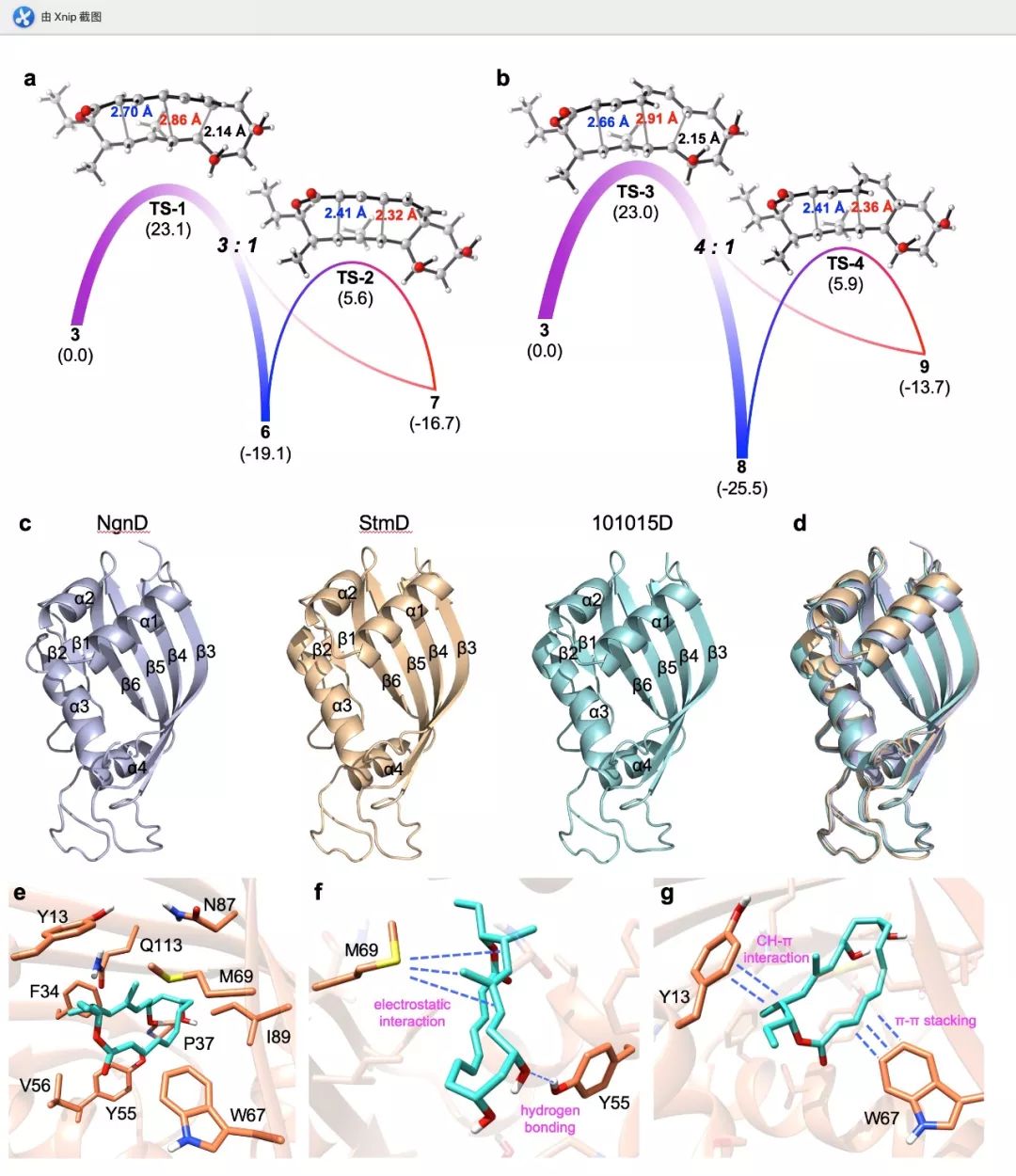
图2 周环酶的催化机制研究
为了理解酶的结构对催化反应的影响, 研究人员培养获得了StmD, NgnD和101015D(以StmD为探针从基因数据库中找到的功能类似酶)的晶体(图2(c))。有意思的是, StmD, NgnD和101015D的蛋白空间结构非常相似(图2(d))。基于NgnD的晶体结构的一系列分子对接、计算机模拟和点突变实验发现, 酶与底物间的各种作用力对催化这类环加成反应起着重要作用, 阐明了NgnD和StmD催化[6+4]/[4+2]反应的机制(图2(e)~(g))。
该研究工作在大环内酯化合物streptoseomycin及类似物的生物合成研究中, 首次发现并鉴定了一类能够催化[6+4]/[4+2]环加成反应的酶, 极大地拓展了人们对自然界中周环反应酶的结构和功能的认识。结合酶工程, 有望对未来进一步通过酶催化实现各种含有复杂多环骨架的天然产物、药物分子和生物活性分子的的高效生物合成提供重要思路和参考。
参考文献
1. Kim H J, Ruszczycky M W, Choi S H, et al. Enzymecatalysed [4+2] cycloaddition is a key step in the biosynthesis ofspinosyn A. Nature, 2011, 473: 109–112
2. Li S, Lowell A N, Yu F, et al.Hapalindole/ambiguine biogenesis is mediated by a Cope rearrangement, C–Cbond-forming cascade. J Am Chem Soc, 2015, 137: 15366–15369
3. Andrews P R, Smith G D, Young I G. Transition-state stabilization and enzymic catalysis. Kinetic and molecularorbital studies of the rearrangement of chorismate to prephenate. Biochemistry, 1973, 12: 3492–3498
4. Ohashi M, Liu F, Hai Y, et al. SAM-dependentenzyme-catalysed pericyclic reactions in natural product biosynthesis. Nature, 2017, 549: 502–507
5. Zhang B, Wang K B, Wang W, et al. Enzyme-catalysed [6+4] cycloadditions in the biosynthesis ofnatural products. Nature, 2019, DOI: 10.1038/s41586-019-1021-x
来源:kexuetongbao 科学通报
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3ODgxMzc1Ng==&mid=2650446641&idx=1&sn=02a14a2c839180262a73e93c978e73a1&chksm=87b33462b0c4bd745f963cf38a637e8c034d46a5fd9cc82665970b09946cfeae1fbc39af8dd0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn