科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-14
来源:BioArt
A20(又称为TNF inducible protein 3,TNFAIP3)是一种去泛素化酶,在抗炎过程中行使重要作用。GWAS研究显示在银屑病、SLE(systemic lupus erythematosus,系统性红斑狼疮)、克罗恩病、类风湿关节炎等多种人类炎症性和自身免疫疾病中,A20为易感基因。小鼠中缺失A20导致围产期或者出生后一周内死亡,并发致死性多器官炎症。组织特异性缺失A20使小鼠对炎症性和自身免疫性疾病易感。虽然,A20的抗炎症功能对于人和小鼠都是不可或缺的,但A20在体内的抗炎机制目前还存在争议。
通常认为,A20主要通过抑制NF-κB活化,行使抗炎功能。A20通过降解K63连接的泛素化链阻止IKK和TAK1招募到上游受体,抑制NF-κB的激活过程【1】。另外有报道,A20使RIPK3去泛素化,抑制细胞坏死,而且RIPK3的缺失能够延长A20-KO小鼠的存活。但MLKL(坏死过程中另一重要分子)的缺失并没有改善A20-KO小鼠的存活【2】,使得坏死过程在A20缺失致病过程中的作用有待进一步研究。
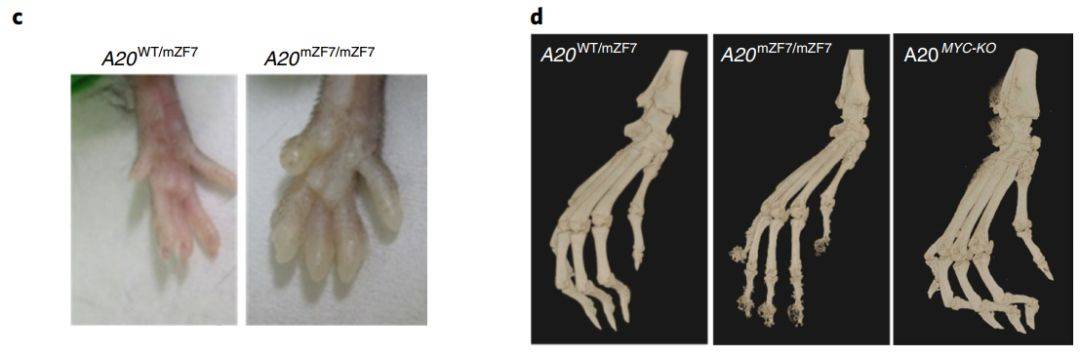
2019年5月14日,比利时的Marietta Armaka、Geert vanLoo和德国的ManolisPasparakis共同合作在Nature Cell Biology杂志上发表文章A20 prevents inflammasome-dependent arthritis by inhibiting macrophage necroptosis through its ZnF7 ubiquitin-binding domain,揭示出A20缺陷巨噬细胞中,RIPK1/RIPK3/MLKL介导的细胞坏死驱动炎症小体的活化,引发炎症。A20的ZnF7结构域间接抑制巨噬细胞坏死,阻止炎症小体依赖的关节炎的发生,发挥抗炎功能。

该研究团队之前报道,髓系细胞中特异性缺失A20的小鼠有自发的炎症性关节炎病变,模拟类风湿关节炎病变。NLRP3、caspase-1和IL-1R1等炎症小体活化的关键因子的全身敲除大大缓解了关节炎的病发。研究团队进一步在髓系细胞中缺失ASC(apoptosis-associatedspeck-like protein containing CARD),即A20MYC-KOAscMYC-KO,发现ASC的缺失明显改善A20MYC-KO小鼠的关节炎症状,包括关节炎症、骨和软骨损伤。巨噬细胞固有的炎症小体活化在A20缺失驱动关节炎发展中起重要作用。虽然A20被认为主要通过抑制NF-κB的活化发挥抗炎作用,但缺失NF-κB通路中重要分子IKK2(即A20MYC-KOIKK2MYC-KO)并没有改善A20MYC-KO小鼠的关节炎症状。
同时, MyD88的缺失明显抑制A20MYC-KO小鼠的关节炎发展、脾肿大及髓系细胞增生等症状,研究人员在髓系细胞和非髓系细胞中敲除MyD88,显著改善A20MYC-KO小鼠的关节炎病症和炎症状态。尤其在滑膜成纤维细胞中,IL-1β和IL-1α激活IL-1R及下游的MyD88信号,介导A20缺失导致的炎症性疾病。
RIPK3能够通过诱导MLKL依赖的细胞坏死和细胞凋亡调控炎症,A20参与调控RIPK3信号,发挥抗炎作用。研究人员繁殖了A20MYC-KORipk3 -/-小鼠,A20MYC-KOMlkl -/-小鼠,和RIPK1酶活性缺失的A20MYC-KORipk1 D138N/D138N小鼠,发现RIPK3缺失、MLKL缺失或者RIPK1酶活性缺失都抑制关节炎的发展,降低炎性细胞因子IL-1β、TNF的分泌。进一步研究发现,RIPK3-MLKL依赖的细胞坏死促进A20缺失的巨噬细胞分泌IL-1β、IL-1α。
A20包括一个ovariantumor domain (OTU)结构域和7个ZnF结构域,其中OTU和ZnF4结构域突变对于A20介导的抗炎作用没有影响,ZnF7参与A20对NF-κB和TNFR1下游细胞死亡信号的抑制作用。研究人员突变ZnF7结构域,发现小鼠有骨和软骨损伤、炎症等自发炎症性关节炎病症。ZnF7突变使A20丧失和线性泛素链的结合能力,导致TNFR1信号复合体上线性泛素链降解,炎症性细胞因子IL-1β、IL-1α分泌增加。
总的来说,研究人员揭示了A20缺失导致关节炎的分子机制,深入阐释了A20通过ZnF7结构域结合到TNFR1信号上,调控巨噬细胞坏死过程,抑制炎症小体的活化和关节炎的发展。这些结果为理解A20的作用机制及炎症性疾病的治疗提供了新的思路。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469883&idx=5&sn=c69c9458d858fbe43e813c16e5beaf0a&chksm=84e2e9cfb39560d98e0a1440eb5a237ba0fa2690460adfd5e368f64089f56d03406db8f30e62&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
面对感染,巨噬细胞蛋白质组整体研究

生物物理所揭示病原菌介导的新型泛素化及去泛素化的催化调控机制
探寻巨噬细胞的起源与发育过程

艾玎/曹义海合作揭示巨噬细胞YAP-K63泛素化促进动脉粥样硬化发生的机制

Cell:巨噬细胞通过吞噬作用“全心呵护”心肌细胞线粒体稳态

Nature Biotechnology:巨噬细胞版“CAR”挑战实体瘤
我国学者发现炎症巨噬细胞凋亡机制
面对感染,巨噬细胞蛋白质组整体研究
上海药物所等揭示去泛素化酶USP14新底物及该酶在非酒精性脂肪肝发生发展中的新机制----中国

巨噬细胞重编程可减少炎症,促进组织修复