科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-19
来源:BioArt
核酶是一类具有催化功能的非编码RNA分子,在病毒基因组复制、mRNA前体加工以及选择性剪切等生物学过程中发挥着重要作用。小的自剪切型核酶(small self-cleaving ribozyme)发现于30多年前,长度在50到150 个碱基之间,至今只有九类自剪切型核酶被报道。Hatchet核酶是2015年被发现的几类新型核酶之一。与其他几类同期发现的新型核酶相比, Hatchet核酶是唯一一类酶切位点处于核酶5'末端的核酶。二级结构显示,Hatchet核酶含有四个茎区(Stem) P1、P2、P3、P4 以及三个主要的环区(Loop)L1、L2和L3, 其中L1处于P1的末端,L2与 L3分别处于P3的两端,并分别连接P2和P4 (图A)。
2019年5月14日,浙江大学生命科学研究院任艾明课题组与奥地利因斯布鲁克大学Ronald Micura教授课题组合作在PNAS上长文发表题为 Hatchet ribozyme structure and implications for cleavage mechanism 的研究论文,报道新型核酶Hatchet三维结构及催化机制。

为了探讨Hatchet核酶的催化机制,任艾明课题组利用x-射线晶体学的方法,首次解析了Hatchet核酶产物的三维空间结构(图B)。在晶体衍射数据的收集过程中,该研究得到了美国斯隆凯瑟琳癌症研究中心Dinshaw Patel教授课题组的帮助与支持。
三维结构显示Hatchet核酶产物在晶体中以二聚体形式存在,整体三维结构的稳定与Hatchet核酶分子中L1与L3等远距离的相互作用至关重要,而这些远程相互作用在之前的研究中是没有发现的(图B)。另一方面,研究发现在序列上处于5末端的酶切位点在三维空间上通过折叠处于整个结构的中心,而序列高度保守的碱基也通过折叠分布在酶切位点周围(图B)。此外,研究人员在催化位点处发现一个凹槽口袋,刚好可以容纳酶切位点的另一个碱基(图C)。通过结构比对及分子模拟,还得到了Hatchet核酶的催化前体模型,并且以此模型为基础鉴定了一个对催化过程至关重要的鸟嘌呤G31(图D)。基于结构的碱基或原子位置特异性突变的酶活实验均完美地验证了在结构研究中的新发现。
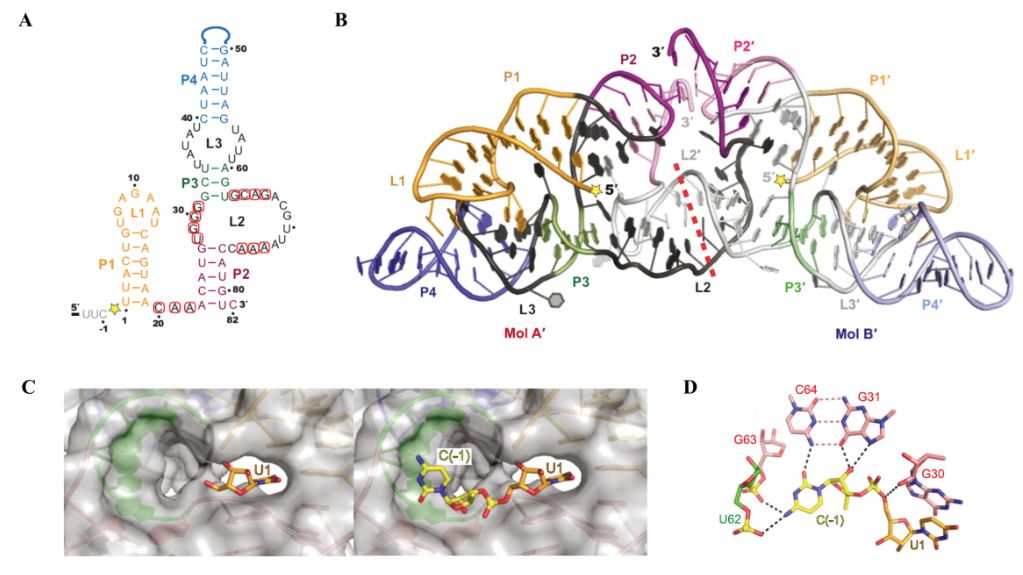
Hatchet核酶产物三维空间结构及催化前体模型
这些工作为研究Hatchet核酶催化机制提供了必要的结构信息;进一步补充了RNA分子的结构数据库;推动了关于几类新型自剪切型核酶的研究进展,也为进一步开发自剪切型核酶的应用提供了一定的理论基础。浙江大学生命科学研究院2016级直博生郑路倩同学为本论文的第一作者。
此外,该课题组自成立之后,还分别在2016年Nature Chemical Biology杂志【1】和2017年的Nature Communications杂志【2】上报道过另外两类新型核酶Pistol(下图1),Twister-sister(下图2)核酶的结构与作用机制研究。至此,已经发现的几类新型核酶结构均已被该课题组解析,基于结构对这些核酶催化机制的探讨,进一步丰富了我们对RNA分子性质的全面认识,为“RNA世界起源说”提供了有力的支持。
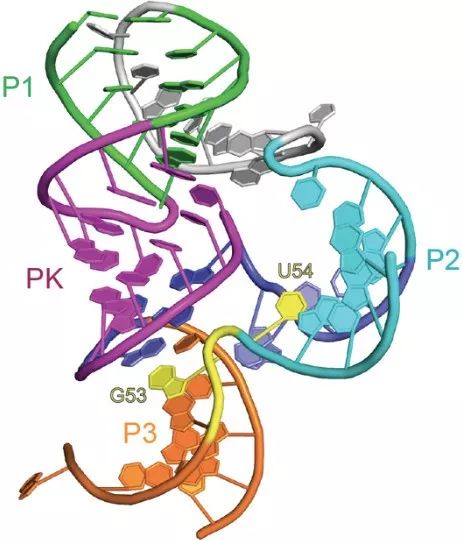
图一、Pistol核酶三维空间结构
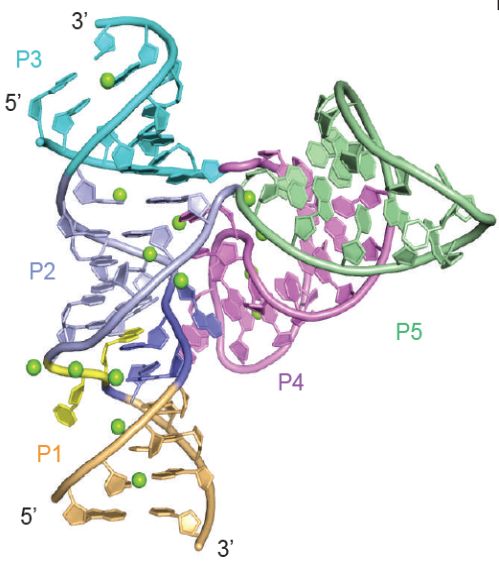
图二、Twister-sister核酶三维空间结构
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470148&idx=5&sn=7fe7112e810f9400a47654e1173ded4c&chksm=84e2e830b39561264bc6e34832e279510e85c29b84b1f78518aa18da159eeb66e2d5634b8c85&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
动物学: 侦察蚁能够引导搬运食物的同窝蚂蚁回家
神经科学:协同工作的大脑
苹果WWDC 2017干货亮点全在这里
三维空间的声波操纵: 高阶拓扑态的应用

2020年国内十大科技新闻
动物学: 加拉帕格斯群岛的鸟儿喜欢吃花
化学:以分子为基础的隐形墨水

超越摩尔定律,将晶体管阵列引入三维空间

【纵览】一周科技新闻

地方学会 | 让作业更高效——2019三维空间信息交流大会在南京召开