科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-20
来源:BioArt
撰文 :胡小话
原标题:Nature Medicine丨 擒贼先擒王——代谢组学分析发现肿瘤干细胞的“软肋”
理解肿瘤细胞的代谢过程能够帮助我们更好地去针对肿瘤细胞的代谢特征进行靶向治疗。然而实体瘤存在很强的异质性,大大增加了靶向治疗的难度,所以科学家把目光投向了肿瘤起始细胞 (tumor-initiating cells, TICs) ,又称肿瘤干细胞 (cancer stem cells) 【1,2】。TICs被认为是肿瘤启动的“源头”,并且对于传统的化疗药具有很强的耐药性,甚至在化疗之后复发成更具侵略性的肿瘤,所以如果能定向清除肿瘤里TICs或许会帮助我们从源头上杀死癌细胞,真正做到擒贼先擒王。
近日,来自新加坡科技研究局 (A*STAR) 的Wai Leong Tam教授研究团队在Nature medicine发表 Methionine is a metabolic dependency of tumor-initiating cells的研究。他们借助代谢组学和同位素示踪的分析方法揭示了TICs具有高度激活的甲硫氨酸循环 (Methionine cycle) 的代谢特征,并且对于外源的methionine具有很强的依赖性。更令人惊喜的是,他们发现用小分子抑制剂阻断甲硫氨酸循环的代谢过程可以非常有效的降低甲基化供体SAM的水平,降低组蛋白甲基化水平,从而使TICs丧失成瘤的潜能。

为了探究TICs的代谢特征,作者首先从非小细胞肺癌 (NSCLC) 样本中获取两株TICs富集的原代细胞系,LC10和LC32,并在无血清的培养基中长成不黏连的肿瘤球 (tumorspheres,TS) 。此外,通过在含血清的培养基中通过不断传代获取贴壁的细胞系 (Adh) 以及在TS中敲低GLDC (甘氨酸脱羧酶,在肺TICs中高表达) 获得GLDC敲低的细胞系 (GLDC) 。作者发现,与TS相比,Adh和GLDC中CD166 (TICs表面标志物) 表达量显著下调,且在小鼠体内成瘤能力显著下降。这些实验表明,只有TS细胞具有TICs的特性,并且该细胞模型可以很好地进行后续的研究。
紧接着,通过对这三种细胞系进行全代谢组学分析,作者发现有三类代谢物差异明显:分别是核苷酸中间产物,支链氨基酸和芳香族氨基酸以及甲硫氨酸循环中相关代谢物。考虑到甲硫氨酸循环中代谢物在TS中高度富集,并且与肿瘤启动的关系并没有被建立,所以作者将甲硫氨酸循环代谢通路选做研究的对象。通过进一步实验发现,甲硫氨酸循环的代谢物Methionine, SAM, SAH以及相关代谢酶SHMT2,MTHFR在TS细胞系中的确是显著上调(见下图),并且其组蛋白的甲基化水平也是显著升高。
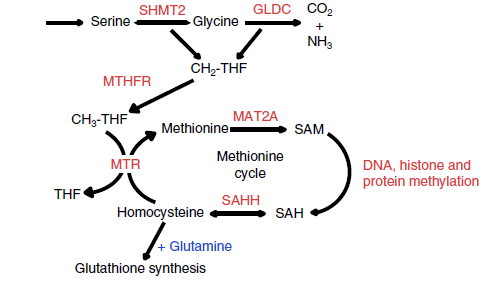
那么,TS中上调的甲硫氨酸循环代谢水平是否与其成瘤特性直接相关呢?为了回答这个问题,作者分别用正常培养基,Methionine缺乏的培养基以及其他氨基酸缺乏的培养基去培养TS细胞。结果表明,只有Methionine缺乏的培养条件能显著下调细胞内组蛋白的甲基化水平,并且细胞的成瘤能力大大降低。
为了进一步说明问题,作者在Methionine缺乏的培养基中分别补加HCY, SAM 和Methionine,结果表明除了HCY,其他两种代谢物都能够很好地回复TS细胞的表型。这说明TS细胞需要通过从外界摄入Methionine合成SAM以维持其表型,另外,由于HCY不能回复TS细胞的表型,这提示从头合成的Methionine可能不足以满足细胞对于合成SAM的需求。为了验证这一猜想,作者用稳定同位素标记的HCY去处理TS细胞,同时选择NIH3T3细胞作为对照,结果表明在TS细胞中几乎检测不到标记的SAM,这说明TS细胞中SAM可能被消耗掉了,并且通过检测下游代谢物SAH和组蛋白甲基化水平也进一步验证了这一猜想。通过这些结果,作者得出一个结论:TS细胞之所以会对methionine形成依赖是因为细胞内高SAM消耗率,需要通过从外界摄取methionine来维持SAM水平,稳定组蛋白的甲基化,从而维持细胞的表型。
基于这一发现,作者猜想,控制SAM合成的代谢酶MAT2A和MTHFR(见上图)可能可以作为针对TICs的一个潜在干预靶点。于是,作者在TS细胞中敲低了MAT2A和MTHFR,发现TS的组蛋白甲基化水平和克隆形成能力均显著降低。最后,作者尝试了两类小分子抑制剂,MAT2A抑制剂FIDAS-5和SAHH抑制剂D9,结果表明,FIDAS-5的确可以非常显著地降低TS细胞内甲基化水平以及成瘤能力。更令人欣喜的是,与传统的化疗药顺铂相比,FIDAS-5的表现更为出色。
综上,该研究团队通过代谢组学的分析方法找到了肿瘤起始细胞 (TICs) 不为人知的代谢特征,即TICs中甲硫氨酸循环代谢通路是高度激活的,并且对Methionine高度依赖。更重要的是,作者的研究揭示了TICs形成 Methionine addiction的分子机制,给肿瘤靶向治疗开发出新的干预靶点,并且前期的小分子抑制剂也取得了非常好的效果,未来有希望在临床上进行应用。
原文链接:
https://doi.org/10.1038/s41591-019-0423-5
制版人:珂
参考文献
1. O’Brien,C.A.,Kreso,A.& Dick,J.E. Cancer stem cells in solid tumors: an overview. Semin. Radiat. Oncol. 19,71–77(2009).
2. Oskarsson,T.,Batlle,E.& Massague, J. Metastatic stem cells: sources, niches,and vital pathways. Cell Stem Cell .14,306–321(2014).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652470175&idx=5&sn=db2c19fdcc6cca8a2595efbd652359e3&chksm=84e2e82bb395613db21d4f3ef90d35220adf71fcc079bfbb927bd75441887815f15894968566&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肿瘤干细胞最新研究进展!
研究团队研制出新型清除肿瘤干细胞候选化合物

【每日科技速递】国家发展改革委:大力推动营商环境改善
实现诱导多能干细胞来源CAR-T细胞抗肿瘤
中美科学家利用新技术揪出肿瘤干细胞中的“静默杀手”
中国抗癌协会肿瘤护理专业委员会在津成立




肿瘤干细胞研究取得进展
Nature | 利用小分子杀死肿瘤干细胞

肿瘤负荷降低94%!《自然》子刊:科学家首次鉴定肿瘤干细胞“致命”氨基酸!

中年人要担心的不只是油腻,45岁起就该开始结直肠癌筛查