科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-20
来源:JIPB
由Gα、Gβ和Gγ组成的异三聚体G蛋白复合体是定位于动植物细胞膜内侧保守的信号转导中枢,其中Gα亚基在控制G蛋白复合体的激活方面起到关键作用。动物细胞中,Gα在静息状态下与GDP结合,而识别了胞外信号的G蛋白偶联受体(GPCR)通过调控Gα与GTP的结合使其激活。植物细胞中,Gα对GTP有相对GDP更高的亲和力。为防止其自动结合GTP而自激活,许多植物通过RGS1蛋白加速Gα的GTP水解酶活性,使其处于结合GDP的抑制状态。然而,这些植物的rgs1突变体并未表现出Gα组成型激活的表型,提示还有其它机制参与调控植物中Gα的激活。鉴于植物Gα被多次报道与细胞膜上的类受体激酶(RLK)发生互作,暗示RLK可以通过磷酸化Gα而调控其激活。此外,拟南芥的经典Gα蛋白GPA1一直被认为主要在非生物胁迫应答方面发挥作用,而其在植物天生免疫中的功能则存在争议。
近日,中山大学李剑峰教授研究组在JIPB发表了题为“BAK1-mediated phosphorylation of canonical G protein alpha during flagellin signaling in Arabidopsis”(https://onlinelibrary.wiley.com/doi/10.1111/jipb.12824)的研究论文,揭示了拟南芥GPA1参与细菌鞭毛flg22信号转导,并能被flg22共受体BAK1磷酸化的调控机制。
该研究首先通过反向遗传学方法证实了GPA1在flg22信号转导通路中起正调控作用,并利用蛋白质磷酸化质谱技术检测到GPA1蛋白在响应flg22时的磷酸化动态改变,包括Thr19位点的去磷酸化和Thr15位点的磷酸化。随后通过使用泛磷酸化抗体确认了flg22会诱导GPA1蛋白整体磷酸化水平的增加。有趣的是,对Thr19位点进行磷酸化缺失或模拟组成型磷酸化突变均能阻断flg22诱导的GPA1磷酸化增加,表明GPA1响应flg22依赖于Thr19的本底磷酸化以及其去磷酸化的动态变化。进一步的体内和体外研究证据表明flg22共受体BAK1很可能介导了GPA1的磷酸化。Thr19位点的动态磷酸化同时还影响了GPA1与RGS1的解离,进而参与调控其激活。整合本研究的发现与此前的文献报道,flg22激活GPA1的机制可大致勾勒如下:静息状态时,BAK1与GPA1结合并通过本底的激酶活性介导了对GPA1 Thr19位点的本底磷酸化,同时RGS1与GPA1结合以保持GPA1对GDP的结合,从而抑制其激活。植物细胞识别细菌鞭毛flg22时会诱导GPA1 蛋白的Thr19位点快速去磷酸化,而flg22激活的BAK1则可以磷酸化GPA1上其它位点,使得GPA1能够与RGS1解离。flg22激活的BAK1同时也磷酸化RGS1,促进磷酸化的RGS1通过胞吞作用与GPA1发生分离,解除对GPA1的抑制作用而使其激活。激活的GPA1进而导致异三聚体G蛋白复合体解离,GPA1与Gβγ(拟南芥中分别对应AGB1和AGG)则各自参与下游的免疫信号转导,调控对细菌的免疫应答。
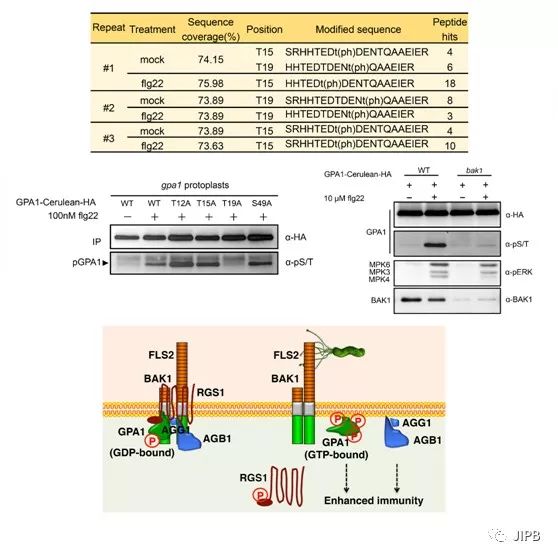
该研究首次为植物RLK能够磷酸化调控经典的Gα亚基提供了植物体内的实验证据,并证实了植物经典Gα亚基的激活受到RLK磷酸化和RGS1介导的GTP结合双重机制的调控。该研究还发现了GPA1上一个潜在的关键磷酸化位点Thr19。Thr19响应flg22的快速去磷酸化可能作为一种对GPA1激活的负反馈调控,防止了GPA1的持续激活。
博士生薛皦、龚本强和已毕业的硕士生姚欣然为该论文的并列第一作者。李剑峰教授为通讯作者。该研究获得了国家自然科学基金面上项目31770295 和31570276的支持。
来源:jipb1952 JIPB
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5ODc5NzY4OQ==&mid=2650204775&idx=1&sn=9e3d82ca8c4512e6df886a063dcf544c&chksm=bec7027189b08b674506c9b1ac57847f72ff76c03e7ffef51598c7adc0470ecb8de1a1a659b6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
蛋白质酪氨酸磷酸化的分子识别研究
2016年全国植物生物学大会在湖北武汉召开
2015上海辰山“药食同源与植物代谢”国际学术研讨会顺利召开

中国科学院遗传发育所在植物磷酸化蛋白质组学技术研发方面获进展
《生命科学》出版植物营养与人类健康专刊

华中农大邱宁组揭示糖基化/磷酸化在禽蛋蛋白质生物功能和食品特性上的作用

北京大学陈鹏课题组和邹鹏课题组合作开发亚细胞磷酸化蛋白质组学新技术SubMAPP
第二届“分子植物”国际学术研讨会在清华大学成功召开
新冠病毒侵染的磷酸化蛋白质组全景图

植物利用细菌获得真菌抗性!中山大学李剑峰课题组揭示植物免疫预警新机制