科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-11
来源:中科院之声
近日,中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室研究员杜宇国、刘思金团队通过多方合作在转化毒理学方面取得新进展。
免疫系统的调控紊乱与多种疾病的发生发展密切相关。目前KRN7000是一种被广泛认可并具有成药潜力的α-GalCer类Th1型免疫反应激活剂。但是由于α-GalCer对Th1型和Th2型免疫反应的选择特异性不强,限制了其临床应用。该团队成功合成了多手性的糖脂类化合物α-GalCer-diol,细胞和动物实验证实α-GalCer-diol能直接诱导树突状细胞和经典CD1d-iNKT轴的激活,其与CD1d受体的结合力显著强于经典的KRN7000化合物(图1)。同时发现,α-GalCer-diol能诱发小鼠体内CD11b阳性细胞数量增加,并活化表达Th1型炎性因子,二者共同作用,显著提高α-GalCer-diol诱导的机体Th1型免疫反应,并在小鼠黑色素瘤模型试验中呈现出显著的抗肿瘤转移活性。该研究克服了α-GalCer在应用中非选择性诱导抗炎/促炎症反应因子表达的缺点,对新型抗肿瘤药物的研发具有指导意义,相关结果发表在Advanced Science上。
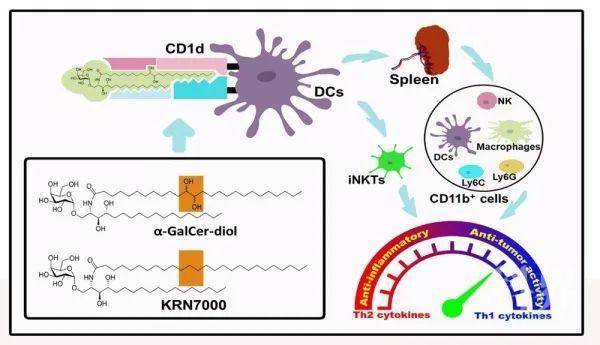
图1. 新合成α-GalCer-diol选择性提高Th1型免疫反应的作用机制
肿瘤和退行性疾病等已成为影响人类健康的重要危害因素。该团队与厦门大学教授郑南峰合作,制备了单分散性钯纳米片(PdPL),以目前严重危害女性健康的转移性乳腺癌为研究对象,在原位以及肺转移肿瘤模型上证实PdPL可以有效靶向原位肿瘤和肺转移瘤,并且单独PdPL特别是协同光热治疗可有效抑制乳腺癌肺转移。进一步通过转录组测序、生物信息学分析和生物化学与分子生物学研究发现,在非毒性暴露剂量下,PdPL通过阻断TGF-β所驱动的上皮-间充质转化(EMT)信号通路来抑制乳腺癌肺转移(图2)。此发现为揭示PdPL等纳米材料的肿瘤治疗机制提供了新策略与依据。相关成果在线发表于National Science Review。同时,该团队在纳米药物促进骨折愈合方面取得重要进展,相关成果发表于Journal of Nanobiotechnology。
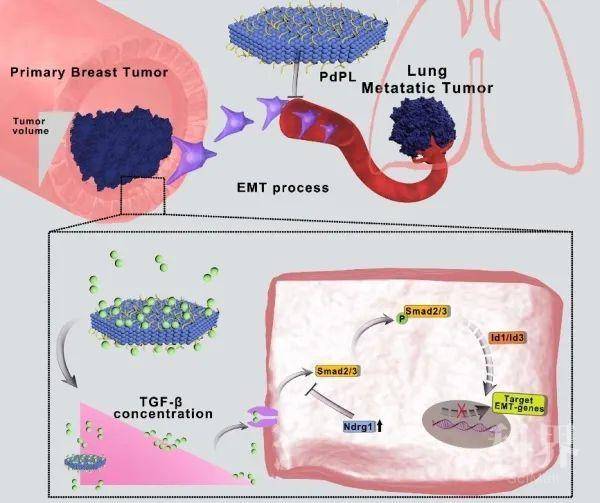
图2. PdPL通过阻断TGF-β驱动的EMT通路来抑制乳腺癌转移机制
以上研究工作得到了国家自然科学基金委项目、北京市自然科学基金委项目和中科院国际合作项目等支持。
来源:zkyzswx 中科院之声
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651780162&idx=2&sn=01c1feabfc80b26a1bcfae7f37eed6c9&chksm=bd271e108a509706c68634ed76e537d7f4ccf6833ff53fe947ba589989c9c961858d449ce16a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国毒理学会组团参加2015年美国毒理学会54届年会


中国毒理学会组团参加2015年第七届亚洲毒理学大会
中国毒理学会第九次全国毒理学大会(第一轮通知)
中国毒理学会毒理学教育专业委员会成立大会在山东济南召开



2016(第二届)毒性测试替代方法与转化毒理学(国际)学术研讨会在杭州成功举办



2015年中国毒理学会毒理学资格再认证通知

关于举行2021年第十三次中国毒理学会毒理学资格认证考试的通知
中国毒理学会组建第二批毒理学科学传播专家团队
中国毒理学会招聘启事
中国毒理学会参加第十四届国际毒理学大会

