科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-15
来源:生物通
意外和疾病引起的组织缺损严重降低了人们的生活质量,相比自然界的某些动物,例如蝾螈和壁虎,人类截肢后的再生能力十分有限,大段骨缺损的修复仍然是一个重大的临床挑战。
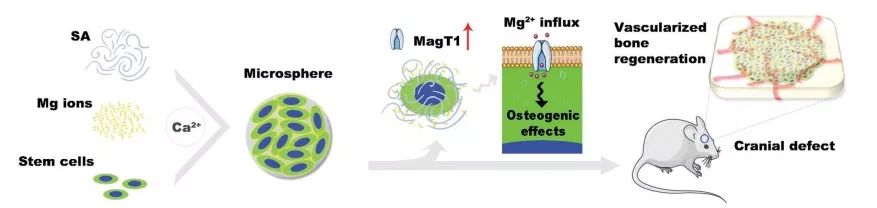
有些动物,如蜥蜴,可以在截肢后再生整个肢体。这一机制的研究表明,所涉及的细胞和分子机制与胚胎发育过程极为相似,干细胞和生物材料的进步改善了人工辅助组织再生策略,为患者们点亮了新的希望之光。
上海交通大学医学院,上海口腔医学研究所的张志愿院士、蒋欣泉教授和张文杰博士等人近期在Advanced Science杂志(IF=12.441)发表了题为“A Magnesium-Enriched 3D Culture System that Mimics the Bone Development Microenvironment for Vascularized Bone Regeneration”的文章,发现了MagT1对血管化骨再生的特定作用,成功地构建了一个富镁3D培养系统,可以模拟骨发育微环境的血管化骨再生。
近年来,生物材料策略在修复大型骨缺损方面受到格外关注,以前的研究报告称,生物材料的结构和组成尽可能地模拟天然骨组织,可显著提高骨再生效率,例如将天然存在于骨基质内的生物活性离子,如铜离子、锶离子和镁离子(Mg2+)加入骨替代物中,可刺激血管化骨再生,然而有关这些生物活性离子的刺激效应的具体机制尚未完全了解。
通过研究小鼠胚胎,研究人员发现镁转运蛋白-1(MagT1)在软骨内成骨区有选择性地高表达,还检测到MagT1在大鼠骨髓干细胞(BMSCs)成骨分化过程中的高表达。有充分的文献证明,软骨内骨化是一种先天血管化骨形成的过程,表明MagT1的表达可用于血管化骨再生。有研究报道,通过生物材料释放Mg2+可诱导大鼠骨髓间充质干细胞MagT1上调。
“因此,我们推测局部Mg2+积聚导致Magt1高表达可能模拟骨发育的微环境,从而诱导血管化骨形成。”文章作者写道。本文重点探索了构建血管生成和成骨微环境的最佳Mg2+浓度,以及通过MagT1的下游信号通路,以阐明MagT1对血管化骨再生的特定作用。
首先,通过评估MagT1的表达水平,筛选出创建成骨微环境的最佳Mg2+浓度,并将其与干细胞的成骨分化能力相对应。体外成骨诱导使用了赛业生物(Cyagen Biosciences, Inc., USA)成骨培养基,培养基中富含不同浓度的Mg2+,低浓度(0.1 × 10−3 M)抑制骨髓间充质干细胞(BMSCs)分化,高浓度(18× 10−3 M)对骨代谢有不利影响,其中2.5× 10−3 M和5× 10−3 M组的MagT1表达显著增加,综合来看,2.5× 10−3 M至5× 10−3 M的Mg2+浓度为成骨诱导的最佳浓度。
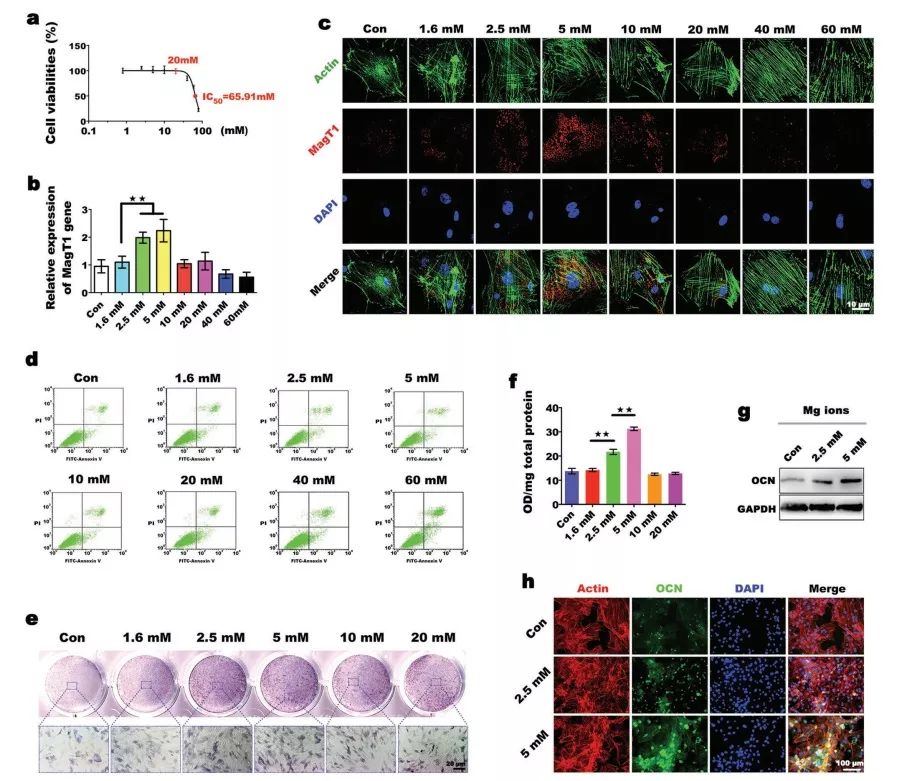
图1.Mg2+通过高表达的MagT 1促进成骨分化
随后讨论Mg2+成骨诱导作用的分子机制。先将BMSCs培养于富含5× 10−3 M Mg2+的培养基中,在不同时间点收样进行Western Blot,结果表明Mg2+通过选择性地激活MAPK/ERK通路诱导干细胞成骨分化,并且诱导成骨作用与MAGT1介导的Mg2+流入密切相关。。
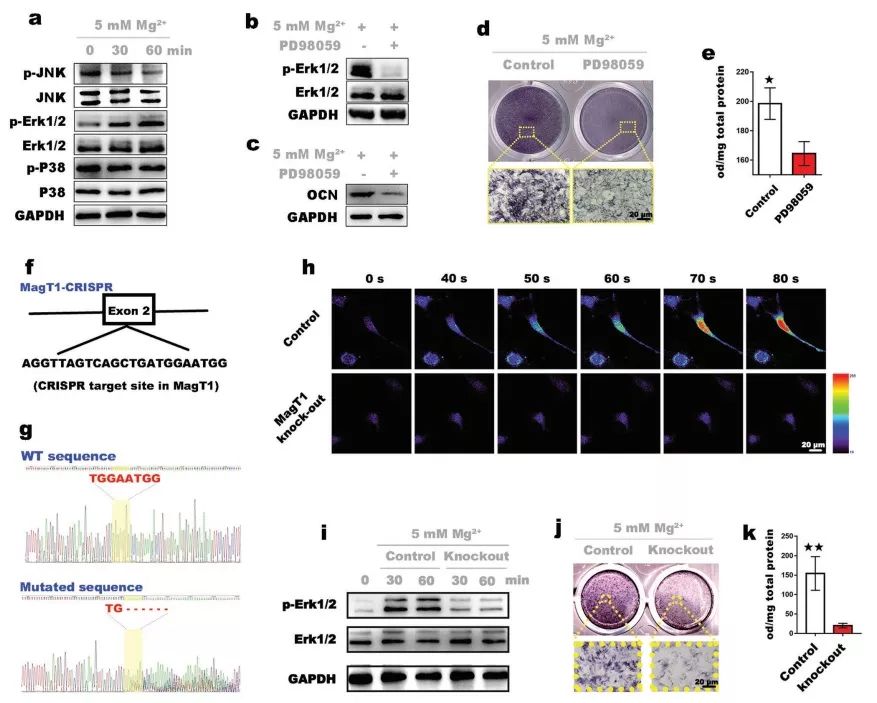
图2.Mg2+的骨诱导机制研究
接下来,研究人员着手制备合适尺寸的富镁微囊以保证囊封细胞活力,一系列实验表明,他们的富镁微环境不仅能刺激干细胞成骨分化,还能促进新生血管形成,在大鼠体内使用这些富含Mg2+的细胞运载工具可观察到明显的血管化骨再生。
总而言之,研究人员的的生物再生方法为干细胞构建一个类似胚胎的微环境是一种很有潜力的骨再生策略,构建模拟发育微环境的生物材料可能为获得更好的再生效果提供一种工具。
参考文献:
A Magnesium-Enriched 3D Culture System that Mimics the Bone Development Microenvironment for Vascularized Bone Regeneration
来源:gh_c1fce5726992 生物通
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675529661&idx=2&sn=adeff2d304f768e4a701ba9700d467d3&chksm=bc51fe2c8b26773a5977b0762d7491ea4b548c3d496a37451c671bad6ce4be092bada64dd60f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中国微循环学会周围血管疾病专业委员会成功召开2015学术年会暨第二届朝阳血管医学论坛
研究揭示人胚胎干细胞衍生心血管前体细胞胞外囊泡的心脏保护作用及机制

间充质干细胞来源的小细胞外囊泡可促进心肌梗死后的血管生成
神经干细胞或能转化为血管

血管病聚焦微循环 全方位探索新思路

中国微循环学会周围血管疾病专委会主委郑月宏教授当选国际血管外科学会副主席
中国微循环学会周围血管疾病专业委员会2016学术年会暨第三届朝阳血管医学论坛
自体血清干细胞

分子细胞卓越中心等发现Zeb1调控血管内皮干细胞静息的机制
首届亚太血管学术联盟深圳会议暨第三届深港澳血管论坛(SVF2016)会议通知