科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-15
来源:BioArt
原标题:专家点评Cell Research封面论文 | 刘志华组揭示肠道菌群可促进胰岛素的分泌
数以百亿计的微生物与宿主构成共生关系,越来越多的证据表明肠道微生物在帮助宿主对食物的消化吸收之外的其它生理活动中也发挥了重要作用,解析肠道微生物与宿主各器官间的互作关系有助于在分子水平理解肠道菌与宿主在长期的共进化过程中演化出的共生机制。
参与代谢调控是肠道菌影响宿主机体健康的重要方面。一方面肠道菌通过其强大的代谢能力以降解肠道中复杂多糖与宿主实现互利互惠【1】,另一方面,肠道菌的定植与胰岛素抵抗密切相关【2】。因此,肠道菌的定植势必增加机体对胰岛素的需求。已有研究发现了肠道菌来源的短链脂肪酸通过激活迷走神经促进胰岛素分泌【3】。而胰岛细胞能否直接感知肠道菌来源的信号而调控胰岛素的分泌目前尚无报道。
2019年6月15日,中科院生物物理所刘志华团队在Cell Research上发表文章Intestinal Lysozyme Liberates Nod1 Ligands From Microbes to Direct Insulin Trafficking in Pancreatic Beta Cells,发现胰岛beta细胞通过表达胞内细菌肽聚糖受体Nod1来感知肠道菌的配体信号,以协助胰岛素囊泡的顺势转运,促进胰岛素的分泌。该工作入选2019年Cell Research第七期封面论文。

研究者发现肠道菌的存在影响着胰岛素分泌囊泡在胰岛beta细胞中的分布。在SPF小鼠胰岛beta细胞中,胰岛素弥散分布于整个细胞质,而在失去肠道菌刺激的无菌小鼠(Germ-Free,GF)小鼠中胰岛素聚集于近核区,与胰岛素前体共定位。该现象说明肠道菌信号对于胰岛素囊泡的成熟与分泌至关重要。 为了进一步解析胰岛beta细胞响应肠道菌信号的分子机制,研究人员对GF小鼠回补了不同肠道菌配体,发现只有激活模式识别受体Nod1的肠道菌肽聚糖组分能够促进胰岛素囊泡向近质膜区的转运。研究者发现,胰岛beta细胞中高表达胞质肽聚糖受体Nod1,当在胰岛beta细胞中特异性敲除Nod1,SPF小鼠可产生与GF小鼠类似的胰岛素转运、分泌障碍,并明显了降低了小鼠的糖耐受能力,加剧了高脂饮食诱导的高血糖。
研究人员对Nod1促进胰岛素囊泡转运的机制深入解析,发现胰岛beta细胞受肠道菌来源配体直接调控的分子机制。在Nod1配体刺激下,胰岛beta细胞Nod1转位于胰岛素分泌囊泡表面,招募下游的接头蛋白Rip2及内膜转运关键小GTPase Rab1a至囊泡表面,促进胰岛素分泌囊泡的成熟与顺势转运。有意思的是,该研究发现了肠道溶菌酶是水解肠道菌细胞壁产生Nod1配体的关键蛋白。溶菌酶的缺失导致小鼠血液中Nod1配体含量显著下降,Nod1-Rip2-Rab1a不能定位于胰岛素囊泡,进而阻碍胰岛素分泌。也就是说,肠道菌调控胰岛素分泌的过程依赖于小肠潘氏细胞溶菌酶的释放,而溶菌酶的敲除切断了肠道菌-胰岛之间信号传递。
该研究工作表明,在常规SPF小鼠中,由肠道来源的nod1配体已经在不断的帮助小鼠分泌胰岛素,维持血糖平衡。缺乏Nod1配体IE-DAP的GF小鼠,及Nod1-Rip2敲除小鼠中,胰岛素分泌均出现障碍。给外周缺乏Nod1配体的溶菌酶敲除小鼠回补IE-DAP可有效而直接的恢复胰岛响应血糖变化分泌胰岛素能力。说明了细菌配体与胰岛beta细胞中Nod1受体,对于胰岛细胞正常响应血糖变化,维持糖耐受,改善高脂饮食造成的高血糖至关重要。
该研究工作发现了肠道菌-溶菌酶-胰岛轴参与机体代谢的新功能及分子机制,提示肠道溶菌酶产生的肠道菌衍生物分子在机体生理活动中发挥重要作用。此外,该研究成果不仅揭示了肠道菌通过影响内膜系统的转运参与代谢的这一更广泛的分子机制,更暗示了肠道溶菌酶在肠道菌与机体互作间的桥梁作用,为肠道菌调控肠外组织生理活动的研究提供了新思路。
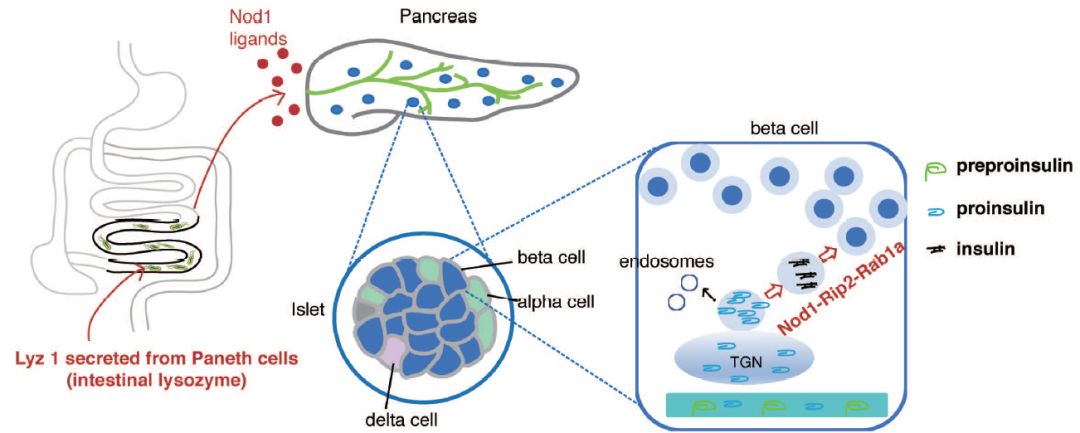
值得思考的是,Nod1与Nod2作为Nod-Like Receptor (NLR)家族的创始成员响应共生菌信号从而促进共生菌与宿主的互利共存,在共生菌-宿主共进化过程中可能是一普遍现象。与该猜想一致的是,源于共生菌的Nod1配体可以调控骨髓干细胞的分化【4】,源于共生菌的Nod2配体促进黏膜助剂的效应【5】,这两个研究集中于天然免疫类细胞,而Nod1与Nod2等天然免疫受体是否在非免疫细胞中响应共生菌信号而发挥广泛的生理作用值得进一步探究。

2019年Cell Reearch杂志第七期封面。
专家点评

朱书(中国科学技术大学教授,主要从事免疫与肠道微生物相关研究工作)
肠道微生物与人类的健康息息相关,近年来,随着对肠道微生物研究的深入,人们发现肠道微生物影响了诸如炎症性肠病(IBD)在内的消化系统疾病,二型糖尿病(T2DM)在内的代谢类疾病与帕金森氏症(PD)在内的神经系统疾病等。今年5月30日,美国国立卫生研究院(NIH)发布了人类微生物组计划(HMP)第二阶段的研究成果(特别报道Nature丨人类微生物组计划第二阶段(iHMP)完成),通过时间动态变化和多组学分析,阐释了肠道微生物与疾病之间的动态关联,对宿主-微生物的互作进行了更深入的探讨。
刘志华教授在肠道共生菌与宿主互作领域做出了一系列杰出的工作,其近期工作揭示了Nod1/2介导的囊泡运输的分子机制。本篇文章是肠道共生菌调控代谢的又一杰出例证。作者通过对饲养在有菌环境(Specific Pathogen Free, SPF)的野生型小鼠与饲养在无菌环境(Germ Free, GF)的小鼠的胰岛进行分析,发现无菌小鼠的胰岛素产生受损,而且胰岛素在β细胞内的分布异常。由此现象作者猜测宿主对于肠道微生物的识别能够影响β细胞的胰岛素产生与胞内分布,从而影响机体糖代谢。那么β细胞是如何响应肠道的信号?作者首先发现β细胞的Nod1/Rip2信号通路能够通过招募Rab1a使其定位到致密核心囊泡从而调节胰岛素的囊泡运输与胞内分布,证明了胰岛β细胞中存在一条Nod1受体相关的调控胰岛素的信号通路。那么肠道的信号又是如何传导到β细胞的?作者发现肠道潘氏细胞(Paneth Cell)溶酶体释放的肠道细菌来源的Nod1配体能够激活胰岛β细胞内的Nod1/Rip2信号通路,从而影响了β细胞的胰岛素的囊泡运输与胞内分布,证明了肠道的确存在这样一条受肠道上皮细胞与肠道菌互作而释放Nod1配体的途径。至此,作者详尽地阐明了一条肠道微生物-内分泌系统的代谢调控通路。
这篇文章表明,宿主与微生物在共生演化中形成了一条肠道-胰岛轴对宿主的胰岛素水平进行调控,这也为微生物-宿主的互惠共生关系提供了又一个杰出例证。
原文链接:
https://www.nature.com/articles/s41422-019-0190-3
制版人:珂
参考文献
1. Cockburn DW, Koropatkin NM. Polysaccharide Degradation by the Intestinal Microbiota and Its Influence on Human Health and Disease. Journal of molecular biology 2016, 428(16): 3230-3252.
2. Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, et al. The gut microbiota as an environmental factor that regulates fat storage. Proceedings of the National Academy of Sciences of the United States of America 2004, 101(44): 15718-15723.
3. Perry RJ, Peng L, Barry NA, Cline GW, Zhang D, Cardone RL, et al. Acetate mediates a microbiome-brain-beta-cell axis to promote metabolic syndrome. Nature 2016, 534(7606): 213-217.
4. Hergott CB, Roche AM, Tamashiro E, Clarke TB, Bailey AG, Laughlin A, et al. Peptidoglycan from the gut microbiota governs the lifespan of circulating phagocytes at homeostasis. Blood 2016, 127(20): 2460-2471.
5. Kim D, Kim YG, Seo SU, Kim DJ, Kamada N, Prescott D, et al. Nod2-mediated recognition of the microbiota is critical for mucosal adjuvant activity of cholera toxin. Nature medicine 2016, 22(5): 524-530.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471293&idx=1&sn=7400bfb6722482a4885c3311fb1d093b&chksm=84e2ec49b395655f0b1e8882d5169622a608a111a657f817f98b51f2fd9487ed529f9eac4f77&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Cell亮点 丨胰岛素受体调控基因表达的新方式
【科普】关于胰岛素注射
胰岛素检查

《微生物学前沿》:出门晒晒太阳吧!你的肠道菌群会更好 | 肠道君周刊
附属瑞金医院首次揭示降糖药疗效和肠道共生菌群特征关系
胰岛素抗体

《细胞》子刊:补觉无法弥补缺少的睡眠,还会破坏昼夜节律

王志珍院士访谈录(下):方得始终,我的科研工作 | 科学春秋
胰岛素抗体
2017年中国药学会药学网络大讲堂(第六期)-慢病治疗与管理专场三在广州举行


