科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-11
来源:科研圈
图片来源:论文作者提供
来源 武汉大学药学院组合生物合成与新药发现教育部重点实验室
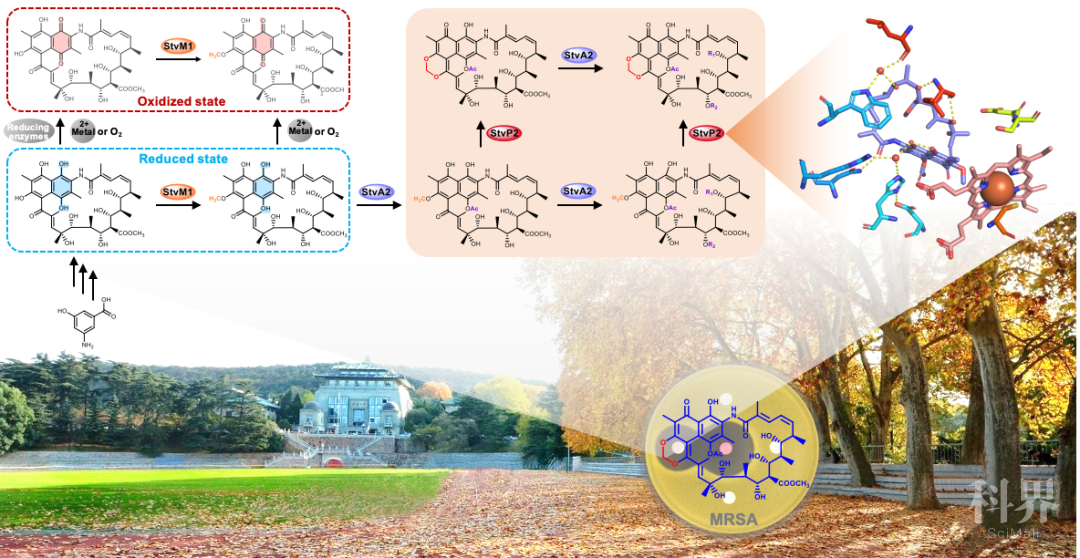
9 月 9 日,《自然・通讯》(Nature Communications)在线发表了武汉大学药学院孙宇辉教授和张郑宇特聘研究员课题组关于活性天然产物曲张链丝菌素(Streptovaricins)中亚甲基双氧桥结构生物合成机制的重要研究进展[1],此研究得到国家重点研发计划、中国科学技术协会青年精英科学家资助计划、微生物代谢国家重点实验室开放课题的大力支持。
抗生素的发现是人类抵抗疾病漫长过程中的关键转折点,但随着在临床上的大量使用,抗生素耐药性已经成为药物研发的重要掣肘。金黄色葡萄球菌是临床上引起感染的常见病原菌。然而,耐甲氧西林金黄色葡萄球菌(MRSA)等耐药菌的出现,使得对这一病原菌感染的治疗变得尤为棘手。因此,发现和创新该类抗耐药菌药物成为了人们的迫切愿望。
在前期针对抗 MRSA 活性天然产物的大量研究中,从武汉大学校园土壤中分离到的一株链霉菌(Streptomyces spectabilis CCTCC M2017417)中发现了一类具有抗 MRSA 活性的萘安莎类抗生素,经鉴定为曲张链丝菌素,它在结构上与著名的治疗肺结核明星药物利福霉素同属一个家族。通过微生物分子遗传学、生物化学等方法,对曲张链丝菌素生物合成中参与活性结构的多个细胞色素 P450 酶编码基因进行了全面探索,并对定向遗传改造获得的曲张链丝菌素系列新结构衍生物的抗 MRSA 活性进行了表征。相关的研究成果已发表于《美国化学会・化学生物学》(ACS Chemical Biology, 2017, 12: 2589-2597)[2]。在此基础上,近期结合结构生物学手段,对曲张链丝菌素中独特且与抗 MRSA 活性密切偶联的亚甲基双氧桥结构的生物合成机制进行了深入的揭示。来源:keyanquan 科研圈
原文链接:https://mp.weixin.qq.com/s?__biz=MzA5NDkzNjIwMg==&mid=2651701023&idx=3&sn=eb12b046fec0afd0e55d3917faf86e6a&chksm=8bbe12fabcc99becdda1036084a0884eaacade7dbedf57064484a2b459a0a24352b22c5981f4#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nat Struct Mol Biol|新型机械力敏感的离子通道OSCA的鉴定、结构解析与机制研究

叶绿素合成关键酶晶体结构首次揭示

科学家解析非洲猪瘟病毒关键酶结构
基于合成蛋白骨架的多酶自组装纳米结构




叶绿素合成关键酶三维结构首次被解析

【复材资讯】形状记忆聚合物微纳米纤维膜在生物医学中的应用进展

新型机器人可编织玻璃纤维结构

人体细胞内存在“铁路”系统,能自动优化结构
【复材资讯】科学家首次实现陶瓷4D打印
人类血管紧张素转换酶全长结构首次测定