科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-23
来源:BioArt
程序性坏死 (Necroptosis) 是由RIPK1-RPK3-MLKL信号通路介导的一类细胞死亡方式,并且广泛参与到发育、增殖、免疫、机体稳态等一系列生理过程的调控当中【1】。TAM (Tyro3,Axl,Mer) 受体家族作为酪氨酸激酶可以通过激活PI3K,MAPK,以及Rac通路来维持细胞的生存与增殖。已有研究表明,TAM激酶是一个促癌蛋白,并且在清除凋亡细胞和抑制炎症过程中发挥重要作用【2】。
2019年6月20日,来自哈佛医学院的袁钧瑛教授在 Molecular Cell发表了题为TAM Kinases Promote Necroptosis by Regulating Oligomerization of MLKL的研究,报道TAM可以通过调控MLKL的低聚化来促进细胞程序性坏死,重新定义了TAM在这一通路中所扮演的角色。

作为细胞死亡研究领域的开拓者之一,袁钧瑛教授实验室在阐明凋亡和坏死等多种细胞死亡形式的分子调控机制的过程中做了很多开创性的工作。该实验室于2008年发表的一篇Cell文章中,利用全基因组siRNA筛选的手段找到了1522个调控Necroptosis(程序性坏死)相关基因【3】。为了进一步阐明Necroptosis在调控炎症信号通路是否存在新的调控因子,作者将Necroptosis相关基因与已知可以调控炎症和细胞死亡的基因取交集,最终筛选出来20个基因,其中评分最高的就是TAM激酶受体家族的Tyro3。为了探究TAM激酶在Necroptosis的作用,作者用CRISPR-Cas9的方法在HT-29细胞(该细胞系中Tyro3蛋白高表达,而Axl和Mer表达很低)中构建了Tyro3 KO的细胞株。他们发现,Tyro3 KO的细胞能抵御TSZ (TNFα+SM-164+zVAD) 诱导的细胞坏死,并且在Tyro3-/- Axl-/- Mer-/-小鼠的原代MEF细胞中也观察到了同样现象,此外,用TAM激酶的抑制剂BMS处理也同样验证了这一结论。这提示,TAM激酶在对于Necroptosis信号通路的传导是必须的。那么TAM是如何调控Necroptosis信号通路的呢?
作者首先猜测TAM激酶可能是通过影响复合体I来发挥功能,但BMS处理并不影响TNFα刺激导致的RIPK1泛素化和IKKβ的降解。此外,将TAM敲除或者用抑制剂处理也不会影响necrosome (坏死复合体) 的形成。更有趣是,MLKL ser358位点的磷酸化 (RIPK3磷酸化位点) 也完全不受影响。但是作者意外发现MLKL的低聚化在TAM敲除或者BMS处理后受到显著抑制。这些实验证明TAM作用的位点应该位于上游的坏死复合体和下游的MLKL的低聚化之间。
为了探究TAM是否直接调控MLKL低聚化,作者在HEK293细胞中诱导表达了一个可以持续激活的MLKL突变体—-MLKLQ356A,同样,TAM敲除或者用抑制剂去处理均能显著抑制MLKLQ356A低聚化。这说明,TAM的确可以直接调控这一过程。那么TAM调控MLKL低聚化的具体分子机制是什么?作者发现,在TAZ或者TNFα刺激之后,TAM与MLKL之间存在相互作用,这提示TAM作为酪氨酸激酶也许可以通过磷酸化MLKL来发挥功能。果然,体外实验表明,Tyro3可以显著磷酸化MLKL,并且这一结论在体内实验当中也得到了验证。通过质谱手段,作者找到了可能的磷酸化调控位点—Tyr376,并且将该位点突变成不能被TAM磷酸化的phe (MLKLQ356A;Y376F) 则完全抑制了MLKL的低聚化。
紧接着,作者想知道TAM和MLKL的相互作用是如何被调控的。他们发现一个很有趣的现象:N端带GST-tag的MLKL可以与Tyro3互作,而C端Flag-tag的MLKL只有将N端4HB结构域去除才能与Tyro3有相互作用。这说明,MLKL的4HB结构域阻碍其与TAM相互作用,并且可以抑制TAM对Tyr376位点的磷酸化。更为重要的是,根据已发表的MLKL的结构数据,Tyr376位于MLKL T-loop区域,且不暴露在蛋白表面。这提示,可能只有当MLKL的Ser357,358位点被RIPK3磷酸化之后才会暴露出Tyr376位点。见下图。
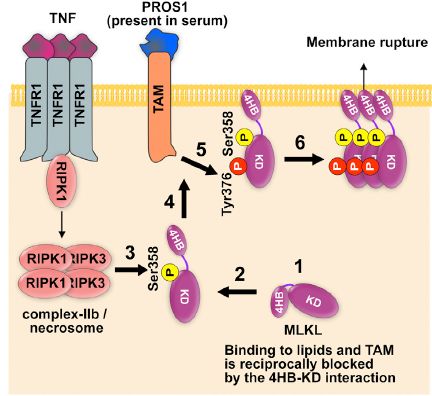
最后,作者对于TAM调控Necroptosis的生理意义进行了探究。Necroptosis在全身炎症反应综合征(SIRS)中扮演重要角色,在小鼠体内敲除RIRK3和MLKL都能起到保护作用。作者发现Tyros3-/- Axl-/- Mer-/-小鼠能很好地抵御SIRS诱导的死亡,另外给野生型小鼠注射TAM抑制剂也能取得类似的效果。
综上,袁钧瑛教授的工作阐明了TAM激酶调控Necroptosis的具体分子机制,并且更新了以往人们对于TAM在细胞程序性坏死信号通路调控作用的认知。更重要的是,这项研究第一次揭示了TAM激酶作为促癌的蛋白激酶与necroptosis之间存在关联,这提示TAM高表达的肿瘤或许会对necroptosis更加敏感,这无疑能给肿瘤治疗提供新的靶点。
原文链接:
https://doi.org/10.1016/j.molcel.2019.05.022
参考文献
1. Yuan, J., and Kroemer, G. (2010).Alternative cell death mechanisms in development and beyond. Genes Dev.24,2592–2602.
2. Lemke,G, and Rothlin,C.V.(2008).Immunobiology of the TAM receptors. Nat. Rev. Immunol.8,327–336.
3. Hitomi, J.,Christofferson,D.E., Ng,A.,Yao,J.,Degterev,A., Xavier, R.J.,and Yuan, J. (2008). Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway. Cell 135, 1311–1323.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471606&idx=3&sn=aacf5c62c9f0b1d44b07a169bb9cd7e5&chksm=84e21282b3959b948a74da3984b51a5b6aaa2ff83f43b3df331d8102d789d9bc348e0d551b60&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【学术前沿】Protein & Cell | 韩家淮/帅建伟合作揭示细胞坏死小体介导细胞命运抉择的定量调控机制
揭示mTOR信号通路调控肠上皮细胞程序性坏死和炎症性肠病的发生机制

亮点丨王晓东团队发现两条负调控细胞程序性坏死的通路

厦大科学家使用超分辨成像技术探清“坏死小体”如何杀死细胞

中国科学家首揭灵长类动物发育和寿命调控的关键通路
上海有机所揭示全新细胞核程序性坏死通路
Matthias Mann团队新研究揭示凋亡Vs坏死性细胞死亡过程蛋白质组差异

【科技前沿】Protein & Cell:韩家淮/帅建伟合作揭示细胞坏死小体介导细胞命运抉择的定量调控机制
营养与健康所揭示细胞程序性坏死及免疫稳态调控新机制

Nature背靠背:莫玮/韩家淮合作揭示干细胞坏死导致自发性肠道炎症的分子机制