科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-12
来源:BioArt
细胞间信号的传递通常需要信号分子的参与。作为细胞膜上种类最为丰富的一类受体蛋白,绝大部分的G蛋白偶联受体(GPCRs)都需要借助cAMP这一第二信使以及它的主要效应蛋白PKA来将外界的信号传入细胞内部。与此同时,一个非常重要的科学问题摆在科学家面前:为什么这些数量庞大的受体蛋白可以通过相同的cAMP信号来使细胞产生不同的响应呢?
上个世纪80年代初,cAMP信号区域化(cAMP compartmentalization)概念的提出似乎解答了这一疑惑:即不同细胞区域之间的cAMP浓度是不同的,从而不同程度地活化了处于不同时空的PKA蛋白【1】。而水解cAMP的磷酸二酯酶(phosphodiesterases,PDEs)被认为在cAMP信号区域化的形成过程中扮演者至关重要的角色。意外的是,后续大量的研究结果则表明cAMP在细胞内具有很强的扩散能力【2】,与之相矛盾的是,PDEs的催化活性却很低【3】,这说明cAMP在细胞内应该会快速平衡,从而不可能形成cAMP信号的区域化。那么,细胞内cAMP信号区域化究竟是否存在以及它的形成机制是什么?这一科学争论持续了数十年却一直没有得到统一的结论。
近日,来自德国赫尔姆霍兹协会分子医学中心的Martin J. Lohse教授研究团队在Cell上发表了题为Optical Mapping of cAMP Signaling at the Nanometer Scale的研究,有望结束这一长期存在的争论。通过合成一个可视化的cAMP小分子,并直接在纳米尺度观测其在细胞内的运动,他们得出了与之前的研究结果相反的结论:正常生理水平的cAMP主要被细胞内的结合蛋白所锚定而具有很弱的流动性,进而为PDEs在其周围形成低cAMP区域创造了条件,并最终导致细胞内cAMP信号区域化的形成。
首先,为了能直接观测到cAMP在细胞内的扩散过程,作者合成了一种带有荧光标签且可以穿过细胞膜的cAMP类似物---8-FDA-cAMP。在证明其与cAMP具有类似的生物学功能之后,作者在细胞内展开了实验。作者惊奇的发现:与之前报道不同的是,基础水平的cAMP在细胞内几乎丧失流动性。为了证明cAMP流动性的减弱可能是被特定的结合蛋白“挟持”所致,作者用forskolin和IBMX刺激细胞来最大程度的升高细胞内的cAMP水平,作者发现在药物刺激的条件下,8-FDA-cAMP的扩散能力显著升高了。这些结果提示:基础水平的cAMP很有可能被细胞内的结合蛋白绑定而失去流动性,而在外界刺激条件下,升高的cAMP会饱和这些结合蛋白从而使得游离的cAMP获得较强的流动性。
为了进一步证明这些结合蛋白的存在,作者比较了8-FDA-cAMP与其他不同分子量的发光物质的扩散速率,其中包括单独的荧光素蛋白(≈0.3kDa),EGFP(≈25kDa)以及融合蛋白Epac1-campus-PDE4A1(≈120kDa),并根据他们的扩散效率与分子量绘制出一条标准曲线。作者发现,与其他发光物质相比,只有生理水平的8-FDA-cAMP的扩散速率要显著低于预期,这提示它们一定与细胞内的大分子发生了结合从而阻碍它们的扩散。另外,通过与标准曲线进行对比,作者推测这些与之结合的蛋白分子量大约在10—50kDa的范围。有趣的是,当给细胞过量的cAMP处理之后,8-FDA-cAMP的扩散速率又与标准曲线预期的一致,这再次验证了作者之前的推论。
那么,在证明基础水平的cAMP由于被细胞内结合蛋白锚定而大大降低其流动性之后,之前的悖论也就迎刃而解。作者推测:cAMP流动性降低使得PDEs具备充分的条件去水解附近的cAMP分子并在细胞内形成不同的cAMP浓度梯度。为了直接在细胞中测量由PDEs产生的低cAMP浓度区域的分子尺度,作者构建了一把“纳米标尺”(见图1)。简而言之,通过将cAMP响应元件与PDE通过一段linker连接在一起,而中间的linker可以使这两个蛋白分隔在特定的距离。借助这把“纳米标尺”,作者测量出PDE形成低cAMP浓度区域的尺度约在10-60nm之间,取决于不同PDEs蛋白的种类。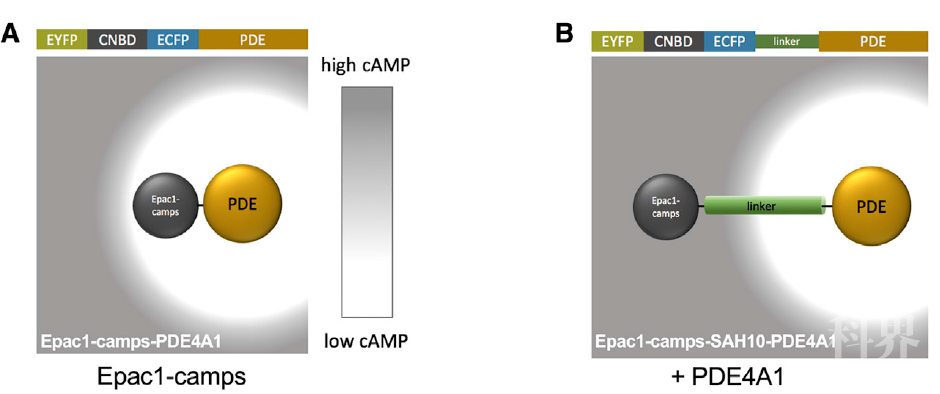
图1 纳米标尺的示意图
最后,总结一下。尽管cAMP信号区域化的概念的提出已经有40年的历史,但一直缺乏强有力的证据支撑。而Martin J. Lohse教授研究团队的这一研究成果则为该假说提供了分子基础,同时,他们在纳米尺度上首次观测到了cAMP浓度梯度的形成以及对PKA信号激活的调控作用,从而第一次在实验层面上证明了cAMP信号区域化的存在。这一发现使得我们对于cAMP通路的复杂性和重要性有了新的认识。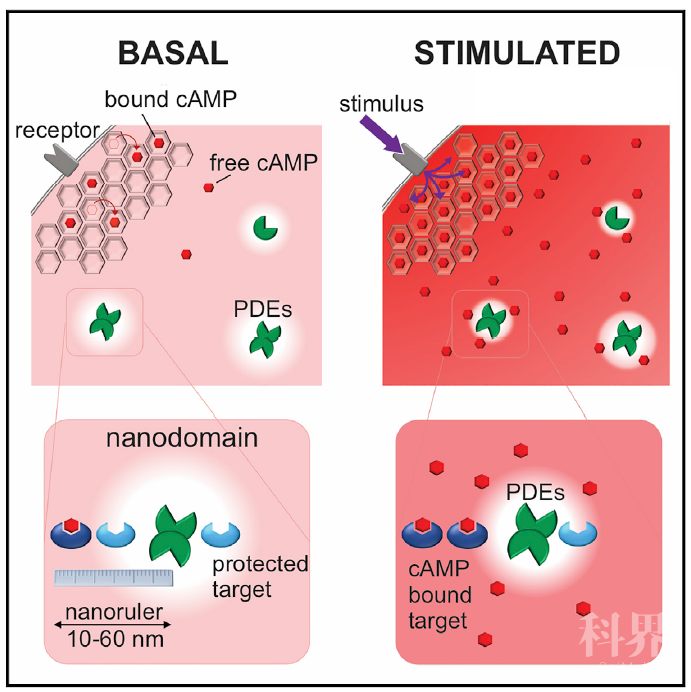
原文链接
https://doi.org/10.1016/j.cell.2020.07.035
参考文献
1. Brunton,L.L., Hayes, J.S., and Mayer, S.E. (1979). Hormonally specific phosphorylationof cardiac troponin I and activation of glycogen phosphorylase.Nature280, 78–80.
2. Bacskai,B.J., Hochner, B., Mahaut-Smith, M., Adams, S.R., Kaang, B.K., Kandel,E.R., andTsien, R.Y. (1993). Spatially resolved dynamics of cAMP and protein kinase Asubunits in Aplysia sensory neurons. Science 260, 222–226.
3. Bender,A.T., and Beavo, J.A. (2006). Cyclic nucleotide phosphodiesterases:molecularregulation to clinical use. Pharmacol. Rev. 58, 488–520.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652499161&idx=1&sn=6479a0312eb69885bc3a541679dfa159&chksm=84e27f6db395f67b7fb9134426a3966c2e6fac0279b7ce052bed16302cc2c2cfa803f3425785#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人体细胞内存在“铁路”系统,能自动优化结构

刺激头发生长新信号分子“现身”
Molecular Plant(《分子植物》)出版“新的信号分子”专刊

免疫信号转导分子能抑制红细胞产生

学术造假必遭严惩,为何仍不断有人冒险
死,而不僵——凋亡细胞的代谢物能作为信号分子调控周围细胞的基因表达模式

北大邓宏魁等首次证明利用化学小分子调控细胞信号通路

分子细胞卓越中心等研究揭示炎症信号通过诱导肝细胞去分化促进肝脏再生

“促癌黑手”Ter细胞首次发现

《BLOOD》:杂志报导了慢性炎症信号导致造血干细胞衰老的关键分子通路