科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-25
来源:BioArt
撰文、责编 | 酶美
PI3K/AKT/mTOR信号通路对于生理条件下细胞生长和稳态平衡至关重要,同时也能促进癌细胞存活和增殖。mTOR是一种丝氨酸/苏氨酸激酶,它接受由营养摄入,生长因子和其他细胞刺激引发的信号,通过其效应蛋白4E-BP1、S6K和ULK1,调节细胞生长、细胞周期、细胞代谢相关蛋白的合成以及自噬。在哺乳动物细胞中,以mTOR为核心存在着两种不同的复合物:mTORC1(由mTORC,mLST8,DEPTOR,PRAS40和Raptor亚基组成)和mTORC2(由mTORC,mLST8,DEPTOR,mSIN1和Rictor亚基组成)。生长因子,如EGF,IGF-1,insulin等,与其相应的细胞表面受体结合,导致下游激酶的顺序激活,包括I类磷脂酰肌醇3-激酶(PI3K),磷酸肌醇依赖性蛋白激酶-1(PDK1)和蛋白激酶B(PKB,AKT)。这些激酶级联反应导致TSC复合物中TSC2亚基的磷酸化,减弱TSC对Rheb的抑制作用。被活化的Rheb激活位于溶酶体表面的 mTORC1,及其下游的4EBP1,S6K与ULK1(图1)。mTORC2复合物常见于细胞膜附近,同样接受生长因子信号激活,调控下游细胞骨架网络的重组、膜脂代谢和AKT信号通路,进而影响mTORC1通路上游TSC的活性和mTORC1的活化。
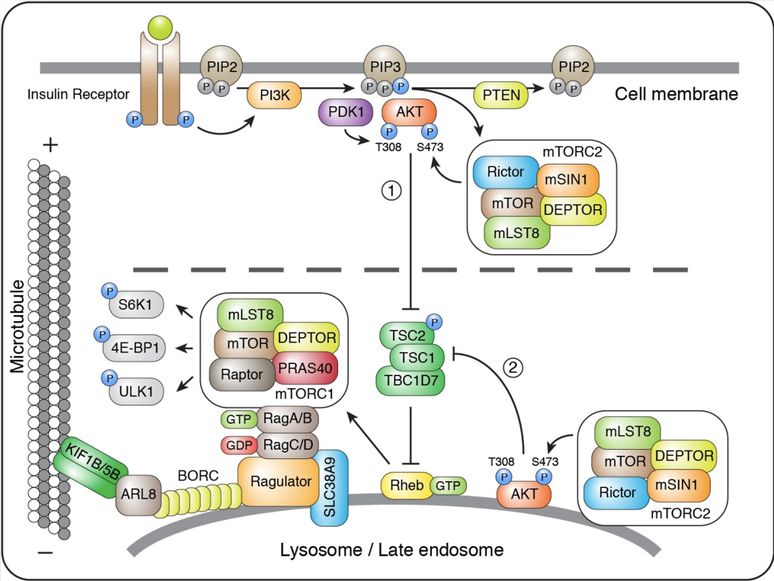
图1 PI3K/AKT/mTOR信号通路的活化。
目前,溶酶体细胞内定位对生长因子信号传导的影响仍然知之甚少。Korolchuk【1】及Hong【2】的研究显示溶酶体/晚期内吞小体在细胞质内的定位影响血清和氨基酸对mTORC1的活化。他们通过敲低(knock down)或过表达介导溶酶体在微管上的转运蛋白,来控制溶酶体在细胞质中的定位。敲低ARL8B, KIF2A,protrudin或FYCO1,使溶酶体在细胞核周聚集,导致mTORC1的活性被抑制。与此相对,过表达ARL8B,KIF2A,KIF1Bβ,protrudin或FYCO1,使溶酶体散布于细胞边缘,增强了mTORC1活性。这些结果表明位于溶酶体表面的mTORC1与上游调节物(例如位于细胞质膜附近的的AKT)的距离决定了mTORC1活化的动力学和程度。相反,最近的一项研究得出了关于溶酶体胞内定位对mTORC1活化的影响的相反结论【3】。在这种情况下,研究人员发现培养基酸化诱导的溶酶体在细胞边缘的散布抑制mTORC1信号传导。尽管mTORC2能够通过AKT调节mTORC1的活化,这些研究均未检测溶酶体定位对mTORC2活性的影响。
近日,Molecular Cell在线发表了美国NIH研究院Bonifacino教授的最新研究成果:Lysosome positioning influences mTORC2 and AKT signaling。研究人员通过CRISPR / Cas9敲除(KO)溶酶体定位相关的蛋白组分来重新检测mTORC1活化和溶酶体定位之间的关系。他们发现细胞边缘定位的溶酶体有助于mTORC1、mTORC2的活化和AKT信号通路激活。

Bonifacino教授长期关注溶酶体胞内定位的调控,实验室前期工作发现溶酶体在细胞质外周的定位依赖于BLOC-one-related complex(BORC)【4】。该复合物由8个亚基组成:BLOS1,BLOS2,Snapin,KXD1,Myrlysin,Lyspersin,Diaskedin和MEF2BNB。BORC与溶酶体膜结合,募集ARL8及驱动蛋白KIF1B与KIF5B到溶酶体表面,驱动溶酶体向细胞膜方向/细胞边缘运输(图1)。与此同时,敲除BORC亚基,ALR8,及KIF1B-KIF5B均可以使溶酶体显著向细胞核周围聚集,且溶酶体的核周聚集对于正常培养条件下的mTORC1活性并没有影响。
作者进一步对KO细胞进行饥饿处理(血清或血清+氨基酸),mTORC1被抑制,从溶酶体膜上解离;然后再重新向培养基中补充血清或血清+氨基酸恢复培养,mTORC1被重新活化。结果表明,KO细胞中的mTORC1活性恢复明显减慢。更出乎意料的是,在相同的饥饿/恢复条件下,溶酶体的核周聚集还延迟了mTORC2和AKT活性的恢复,表明这些激酶的再活化对溶酶体定位也很敏感(图2)。这些结果表明,溶酶体定位不仅影响mTORC1,还影响上游激酶mTORC2和AKT再激活。

图2. 溶酶体的核周聚集影响mTORC2活性的恢复。
使用免疫荧光技术,作者鉴定了mTORC2是否也有相应溶酶体的定位。通过过表达mTORC2的一个亚基mSIN1,发现与溶酶体膜蛋白存在明显的同定位。在BORC KO细胞中,mSIN1更加集中定位于核周区域。在使用甲硫氨酸甲酯 (Methionine methyl ester) 诱导溶酶体膨大后,作者进一步发现mSIN1与mTORC2/mTORC1核心亚基mTOR共定位于溶酶体表面,形成“甜甜圈”形状(图3),再次证明mSIN1与mTOR作为mTORC2整体定位于溶酶体表面,而不是由于过表达造成大量蛋白聚集而定位于溶酶体腔内。
本研究利用CRISPR/Cas9 KO技术特异性敲除溶酶体定位相关蛋白,减少siRNA KD及酸处理细胞引起的副作用,研究溶酶体定位对PI3K/AKT/mTORC1通路的影响。确证了溶酶体的核周聚集减弱了饥饿/恢复条件下mTORC1的活性。同时,本研究首次发现不仅mTORC1,其上游激酶mTORC2/AKT的活性同样依赖于溶酶体在细胞浆中的分布。mTORC2/AKT部分定位于溶酶体表面,溶酶体在核周的聚集使溶酶体定位的mTORC2/AKT难于接受来自细胞质膜的生长因子刺激信号,导致其细胞总体活化的减慢。
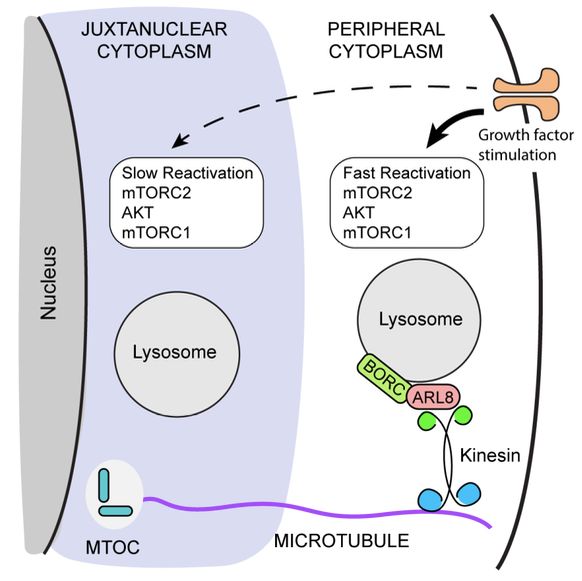
图3
原文链接:
https://doi.org/10.1016/j.molcel.2019.05.009
制版人:珂
参考文献
1. Korolchuk, V. I., Saiki, S., Lichtenberg, M., Siddiqi, F. H., Roberts, E. A., Imarisio, S., Jahreiss, L., Sarkar, S., Futter, M., Menzies, F. M., O’Kane, C. J., Deretic, V., and Rubinsztein, D. C. (2011). Lysosomal positioning coordinates cellular nutrient responses. Nat Cell Biol 13, 453-460.
2. Hong, Z., Pedersen, N. M., Wang, L., Torgersen, M. L., Stenmark, H., and Raiborg, C. (2017). PtdIns3P controls mTORC1 signaling through lysosomal positioning. J Cell Biol 216, 4217-4233.
3. Walton, Z. E., Patel, C. H., Brooks, R. C., Yu, Y., Ibrahim-Hashim, A., Riddle, M., Porcu, A., Jiang, T., Ecker, B. L., and Tameire, F. (2018). Acid Suspends the Circadian Clock in Hypoxia through Inhibition of mTOR. Cell
4. Pu, J., Schindler, C., Jia, R., Jarnik, M., Backlund, P., and Bonifacino, J. S. (2015). BORC, a multiprotein complex that regulates lysosome positioning. Dev. Cell 33, 176-188.com.cn
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471659&idx=5&sn=e59ceee25153834c2ed35e1eb786a4fc&chksm=84e212dfb3959bc91a2a6ef6032be550728634dbca121b87db5db3c36234d59371452cc08ddd&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Nature突破:研究揭示线粒体压力信号通路
质体反向信号调节生长素和乙烯信号通路,调控植物生长发育
Nature | piRNA信号通路新调控因子
Cell Chem Biol | 化学生物学助力开发新型抗胶质母细胞瘤抑制剂

靶向 TNF/TNFR 信号通路的药物及其机制研究
如何使用AI CS6绘制信号通路图

研究找到纳米材料与肿瘤转移相关的信号通路

你以为鸟类的羽毛都是随便长的?

干货 | 细胞信号通路总图(内含59条通路)不容错过!

基因组研究揭示寿星健康保护机制