科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-11
来源:X一MOL资讯
具有轴手性的联芳基化合物是天然产物和手性配体中的重要结构单元,以往的研究主要集中在六元-六元双芳环体系的构建上,而含五元环的联芳基化合物构象不稳定从而易于消旋化,因此其不对称合成更具有挑战性。另一方面,碳氢键活化已成为构建复杂结构的一种重要策略,例如通过双重碳氢键活化可以实现联芳基化合物合成 (CDC反应),但是反应条件通常较为苛刻,因此实现联芳基化合物不对称合成的报道仍然很少,通常都是通过联芳基化合物的动态动力学拆分实现的。
通过C-H键活化对映选择性的合成五元环联芳基化合物的挑战主要在于反应条件的苛刻性。基于Rh(Ⅲ)催化剂在C-H键活化中表现出的高活性和较强的路易斯酸性,近期李兴伟教授课题组将Rh(Ⅲ)催化C-H键活化与亲核环化相结合,高效地合成了一系列消旋的2,3'-双吲哚类化合物 (图1,48例产物),该过程的挑战在于抑制炔烃的简单自身环化过程。在此基础上,利用手性三价铑催化剂也实现了该类化合物在温和条件下的不对称合成 (图2,ee值最高达到97%)。
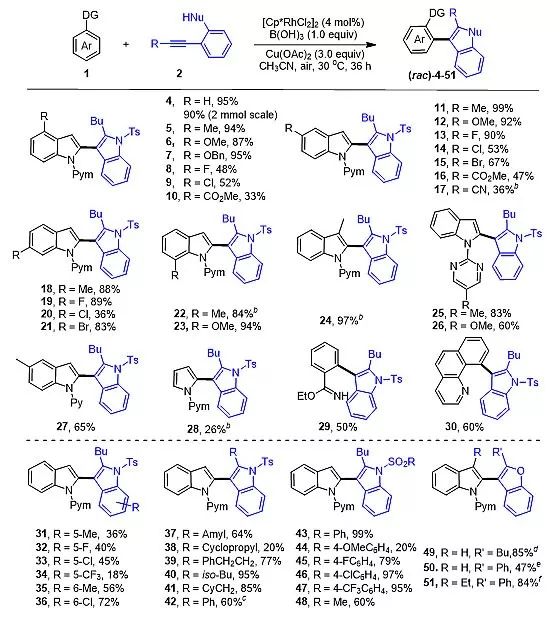
图1. 2,3'-双吲哚类化合物的消旋合成。
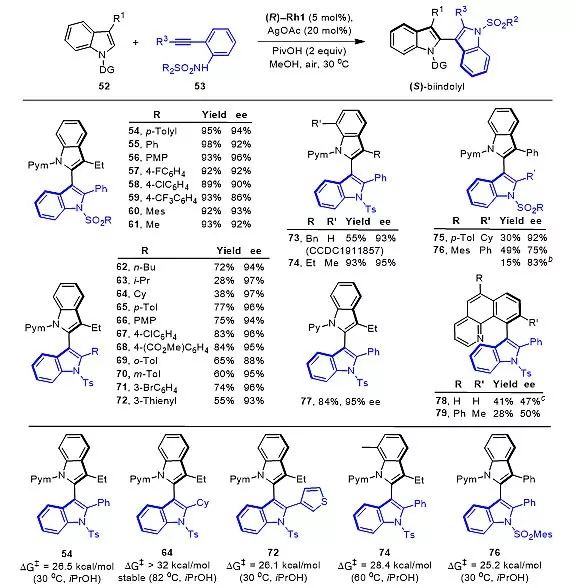
图2. 2,3'-双吲哚类化合物的不对称合成及代表性产物的转动能垒。
作者测定了几种具有代表性的2,3'-双吲哚化合物的转动能垒(图2),发现转动能垒最高的是2'-环己基取代的双吲哚类化合物64(ΔG‡ > 32 kcal/mol, 82 ℃),而大多数双吲哚产物都具有相对较低的转动能垒。为了深入探讨该不对称催化体系的催化机理,作者利用2-甲基-N-嘧啶基吲哚和化学计量的手性Rh催化剂合成了具有单一绝对构型的环铑络合物中间体(图3,CCDC 1911940),在该晶体结构中,位阻较大的碘配体位于手性CpOMe配体的空间屏蔽基团的远端。此外,嘧啶导向基团几乎平行于配体中的萘环,产生一定的π-π堆积作用。配体围绕Rh(Ⅲ)中心的取向与Cramer提出的模型相吻合,可以很好地揭示产物立体构型控制过程。

图3. 环铑络合物的分子结构。
小结
李兴伟研究团队通过将C-H键活化与亲核环化反应结合,实现了吲哚与邻炔基苯胺/酚类化合物的氧化偶联,在温和条件下构建了一系列双芳基化合物。该催化体系以高对映选择性实现了2,3'-联吲哚类化合物的不对称合成。通过化学计量反应首次分离出一例手性环铑中间体,为进一步深入了解Rh(III)催化的不对称C-H键活化反应的立体选择性提供了直接的依据。这一成果近期发表在J. Am. Chem. Soc.上。第一作者为河南师范大学博士研究生田苗苗,通讯作者为李兴伟教授 (河南师范大学兼职特聘教授)。
Rh(III)-Catalyzed Asymmetric Synthesis of Axially Chiral Biindolyls by Merging C-H Activation and Nucleophilic Cyclization
Miaomiao Tian, Dachang Bai, Guangfan Zheng, Junbiao Chang, Xingwei Li*
J. Am. Chem. Soc., 2019, 141, 9527-9532, DOI: 10.1021/jacs.9b04711
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657615282&idx=6&sn=96e19548cbaa24c251cb5acdb33852aa&chksm=80f7d462b7805d743985df438a1d6340e200af405d47bae8c75af57093f18ad7e416eb3f6bc0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
钯(II)/手性螺环磷酸(SPA)催化的轴手性联芳基化合物的立体选择性构筑

有机小分子催化不对称合成吲哚类手性杂环化合物的策略、反应及展望

钯催化的不对称Cacchi反应——构建轴手性2,3-双取代吲哚化合物
无氰源合成手性腈类化合物

Nature:惰性二氟亚甲基单元构建手性单氟化合物
JACS:旧配体新手性!谭斌团队利用BINOL配体高效构筑轴手性联芳基化合物
河南大学发现手性含氮芳香杂环化合物合成新方法
研究发现手性含氮芳香杂环化合物合成新方法

Pd催化的立体选择性Cacchi反应,不对称合成轴手性2,3-二取代吲哚化合物

中性曙红Y和金属中心手性Rh络合物协同控制下的手性1,4-二羰基化合物合成