科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-18
来源:高分子科学前沿
聚醚类材料在日常生活和化学研究中普遍存在,值得注意的是,相似结构的聚醚溶解性差异极大。例如,聚乙二醇(PEG,[–CH2–CH2–O–]n)的水溶性极好,当n ≤ 600时,PEG在水中无限可溶,可广泛应用于化妆品行业。然而,与PEG结构类似的聚甲醛(POM,[–CH2–O–]n)是一种完全不溶于水的塑料。那么问题来了,根据教科书里的经典理论,聚合物重复单元内烃基部分的增加(即其C/O比例的提高),将不利于在水中溶解。显然,这与PEG,POM的水溶性实验结果背道而驰!早在1969年,Blandamer等人指出PEG的优异水溶性来自于溶剂化后产生的氢键网络与周围水分子的氢键网络匹配度良好。但迄今为止,对于相似结构的聚醚(如PEG和POM)之间的水溶性差异的机理解释尚未提出,也成为该领域的一个未解之谜。

基于此背景,近日,荷兰阿姆斯特丹大学的Sander Woutersen教授联合德国马普高分子研究所的Mischa Bonn教授在国际著名刊物《Nature Communications》上发表了名为“On the origin of the extremely different solubilities of polyethers in water”的论文。研究者结合时间分辨振动光谱,介电松弛谱和从头计算分子动力学模拟等手段,提出影响PEG和POM水溶性差异的根本原因在于氧原子的诱导效应,即对水分子的锚定作用。在PEG链中,氧原子的吸电子诱导效应可充分作用于两侧的碳原子上,氧原子附近将具有较高的电子云密度,更强的极性,则与水分子作用力更强,容易溶胀,进一步溶解。然而对于POM,每个氧原子需要与间隔的氧原子“共享”相邻碳原子的电子,因此其周围电子云密度大大下降,不利于其在水中溶解。
图1为理论优化得到的具有三个重复单元的PEG3和POM3中的电荷分布情况,从图中不难发现,与研究者分析一致,PEG3中的氧原子上分布的电荷密度相较POM3更高。
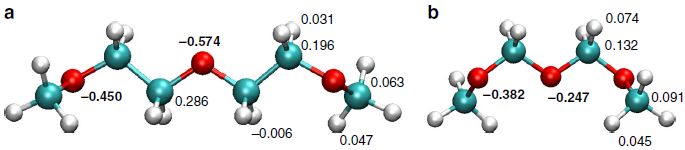
图1. 原子电荷分布:(a) PEG3;(b) POM3.

图2. 0.01, 0.3, 0.5, 20和50 ns下聚合物单元与水分子的动力学模拟图.
研究者根据之前模拟得到的电荷分布情况,进一步引入水分子,模拟其分子动力学,结果如图2所示,显然,一段时间后,PEG3能与水分子产生相互作用,溶胀后进一步溶解,而POM3更倾向于结构间相互聚集,水分子不易插入。但研究者将POM3中的氧原子电荷参数用PEG3中的参数带入修正后,得到POM3*,令人惊讶的是,模拟后最终POM3*结构中插入了许多水分子,理论上具备较好的水溶性。该结果确认了POM与PEG的水溶性差异的根源在于氧原子的电荷分布,即其诱导效应的强弱。
该工作通过理论出发,结合实验,解释了聚醚类物质中富有代表性的PEG和POM的水溶性差异问题,有望应用于解释其他类似体系的水溶性问题以及为预测新型聚合物的溶解性提供参考意见。
全文链接:
https://www.nature.com/articles/s41467-019-10783-z
来源:Polymer-science 高分子科学前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NjM5NzA5OA==&mid=2651720196&idx=1&sn=3b32869294cd40f7a7be1bc905b92459&chksm=8b4a1841bc3d915705e741d45d1f0ca678f427b67b865855bca4e90430bacec88ed2e01e4d37&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中科院等科学家合作研究开发新型聚乙二醇基水凝胶用于创伤性脏器损伤的止血封闭
药物-聚合物杂化大分子工程:内嵌铂(Ⅳ)的可降解PEG用于肿瘤治疗

颜德岳院士团队《Matter》:铂(IV)集成的可降解聚乙二醇用于癌症治疗
Angew:二维单元素锗量子点——新型抗癌光热纳米药物

仿生贻贝“闭环”拓扑结构,显著提升PEG抗污性能

华理刘润辉《JACS》封面:调控细胞特异性粘附—抗污层PEG链长过犹不及!

科研人员开发新型聚乙二醇基水凝胶用于创伤性脏器损伤的止血封闭

化学所吴德成等《先进材料》:开发新型聚乙二醇基水凝胶用于创伤性脏器损伤的止血封闭

《先进材料》:牙齿过敏,不用怕!lyso-PEG纳米薄膜来解决
十二烷基七聚乙二醇醚