科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-25
来源:BioArt
器官发生涉及到多种细胞类型的协调作用,细胞类型特异性的基因网络失调导致出生缺陷,影响约5%的新生儿。心脏的发育有多种细胞参与,包括两群中胚层来源的心脏祖细胞(cardiac progenitor cells,CPCs),第一心区(the first heart fields,FHF)和第二心区(the second heart fields,SHF)以及多能神经嵴细胞。小鼠的胚胎发育到7.75天(E7.75),CPCs在心脏新月晚期开始分化;E8.25,FHF细胞形成线性心脏管,SHF细胞迁移到竖直心脏管前端和后端;E9.25,心脏管开始环化,SHF形成心室出口道(outflow tract,OFT)、右心室(right ventricle,RV)、静脉窦(sinus venosus,SV)、FHF来源的左心室的部分心房和房室管细胞(atrial and atrioventricular canal,AVC)并与心脏管进行整合【1】。最后腔室化,形成四个腔的心脏。先天性心脏病是最常见的畸形疾病,由心脏祖细胞的离散亚群紊乱所导致,但祖细胞的转录改变如何导致组织器官水平的缺陷目前还不清楚。
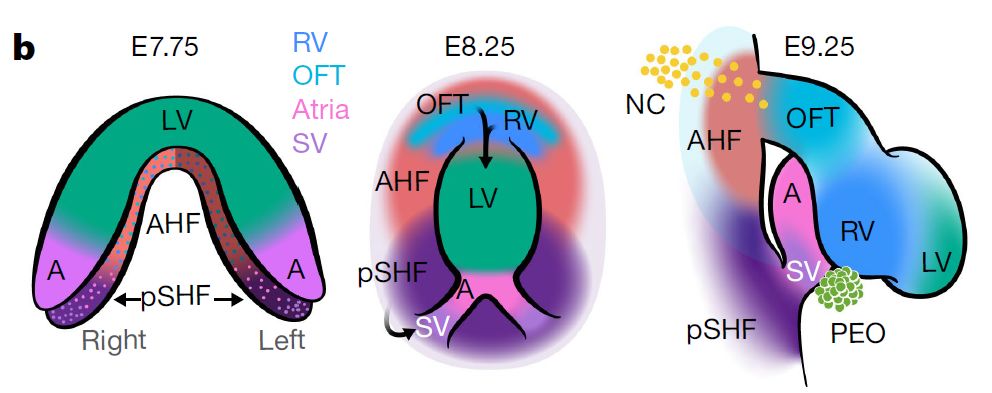
2019年7月25日,来自美国旧金山的Casey A. Gifford和Deepak Srivastava团队合作在Nature上发表了题为Single-cell analysis of cardiogenesis reveals basis for organ-level developmental defects的文章,利用单细胞测序技术揭示了在正常和异常的心脏发生过程中,心脏祖细胞的特化和分化过程。并且阐释了转录因子Hand2是心室出口道细胞(OFT)而非右心室细胞(RV)的特异性决定因子,Hand2缺失的胚胎其心室流出道心肌层特化失败;右心室心肌层特化正常,但分化和迁移过程缺陷,导致Hand2缺失小鼠的右心室和心室出口道形成有缺陷。Hand2的缺失导致视黄酸信号失调,破坏心脏祖细胞的前-后模式形成。

为了探究心脏组细胞中的突变如何导致先天性心脏病,研究人员收集了心脏发生的3个重要时期(E7.75、E8.25、E9.25)的36000个细胞进行单细胞测序。其中21366个中胚层和神经嵴细胞大致分成7个群:多能Isl1+组细胞、内皮或心内膜细胞、心外膜细胞、心肌细胞、神经嵴来源的间质细胞、近轴中胚层和外侧板中胚层细胞。转录组的进一步分析发现,每一个细胞群内部进一步呈现出细胞类型特异性的特征,具有进一步分化潜能。Isl1+多能祖细胞可细分为SHF的前端和后端区域(分别为前心区域(anterior heart field,AHF)和后部的SHF(pSHF))及腮肌祖细胞,并且观察到心室、心房、SV、AVC、OFT心肌细胞的代表性转录组。虽然LV和RV行使相似的功能,但其来源于不同的组细胞,不同细胞群特异性的基因失调将导致腔室特异性的先天缺陷【1】。心室祖细胞可细分为LV谱系细胞、早期分化程度低的RV细胞、分化程度较高的RV细胞。而两侧心室细胞呈现出不同的基因表达图谱,如钙调控的重要调控子Pln(phospholamban)、肠激素Cck(cholecystokinin)主要在RV细胞中表达,这与两侧心室来源和生理功能不同相一致。
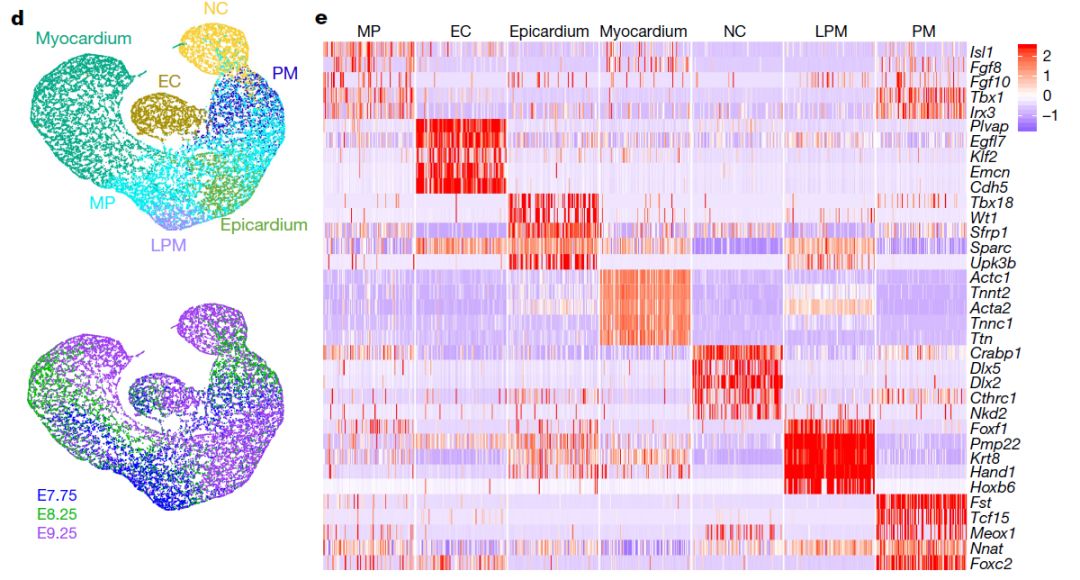
研究团队对心脏祖细胞中的AHF和pSHF细胞群进一步分成9个亚群,A-C群是pSHF来源,E-I是AHF来源。D亚群高表达FHF、LV、横纹肌相关基因,低表达Isl1,表现出早期FHF祖细胞特征;而F亚群展示出最早期OFT细胞特征。Pseudotime分析显示pSHF亚群A、B ,AHF亚群E、F,AHF亚群H、I代表了分化过程中三个连续的阶段;而pSHF亚群C则是分化成心肌细胞。为了探究控制心脏祖细胞分化成不同亚型细胞的调控分子,对AHF、RV、OFT细胞进行谱系决定分析,鉴定出Irx4、Plagl1是RV心肌细胞的调控分子,Hand2、Tead2、Arid3b是OFT心肌细胞命运决定因子。Irx4是已知的心室决定因子【1】,Arid3b对OFT中SHF祖细胞的部署很重要【2】,说明分析结果的可信度高。Hand2的表达在OFT心肌细胞中富集,但是Hand2被预测为OFT的谱系决定因子,而不是RV心肌细胞的,这与Hand2全身敲除导致RV发育不全【3】似乎有些相悖。
为了解决这个问题,研究团队对野生型(WT)和Hand2缺陷型小鼠在E7.75和E8.25的心脏祖细胞进行单细胞测序。Hand2缺陷的胚胎其AHF、OFT、RV祖细胞在E7.75虽然没有形态上的缺陷,但转录组已经失调。比如,Crabp1和Crabp2对视黄酸信号有相反的调控作用,参与到SHF祖细胞在心脏后方的谱系决定【4】。Crabp1通常在AHF中高表达,沉默视黄酸信号加快分解代谢;Crabp2促进视黄酸的核转运和转录激活,在AHF中低表达。Hand2缺陷AHF细胞中,Crabp1被下调,而Crabp2被上调,这就导致视黄酸信号的异位激活和AHF的后置化定位。Hand2缺陷导致OFT和RV细胞异位表达pSHF细胞的标志基因Upp1;OFT标志基因Tdgf1被下调甚至消失。相反地,野生型和Hand2缺陷型的RV细胞中Irx4的表达水平相当,Hand2缺失没有抑制心室的谱系决定;但是RV从分化到成熟心肌细胞的标志物在E8.25被下调,Hand2缺失导致RV细胞的特化过程失调。Pseudotime分析发现,E8.25的AHF、OFT、RV细胞的分化轨道由AHF开始,分成三个细胞状态:一种OFT状态、两种不同的RV状态。Hand2缺陷型细胞严重缺失OFT状态;RV状态1由数量相当的WT和Hand2缺陷型细胞组成;RV状态2主要是WT细胞。这些数据表明Hand2缺陷型OFT命运的细胞特化过程(specification)被打断,RV命运的细胞正常特化,但分化(differentiation)有缺陷,和之前的谱系决定分析结果一致。最后,研究人员用原位杂交的方法证明Irx4+Cck+RV细胞在E8.5定位到LV后面的AHF区域,在E9.25定位到OFT区域,出现错误迁移现象。

总的来说,该研究利用单细胞测序技术揭示了正常的心脏发生机制以及离散的细胞亚群的调控缺陷如何导致形态发育的缺陷,为利用单细胞测序研究器官发生及相关先天性疾病提供了新的思路。
原文链接:
https://www.nature.com/articles/s41586-019-1414-x
参考文献
1. Srivastava, D. Making or breaking the heart: from lineage determination to morphogenesis. Cell 126, 1037–1048 (2006).
2. Uribe,V.etal.Arid3bisessentialforsecondheartfieldcelldeploymentand heart patterning. Development 141, 4168–4181 (2014).
3. Srivastava, D. et al. Regulation of cardiac mesodermal and neural crest development by the bHLH transcription factor, dHAND. Nat. Genet. 16, 154–160 (1997).
4. Xavier-Neto,J.etal.Aretinoicacid-inducibletransgenicmarkerofsino-atrial development in the mouse heart. Development 126, 2677–2687 (1999).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473141&idx=4&sn=e4562532e1e4be1cb5bfbcc868f889e9&chksm=84e21481b3959d973145452823ca4c2a7172617593854b982063306b6fab132e89c1a4b946be&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新突破│小脑奥秘知多少:单细胞基因表达谱揭示小脑细胞分化机制
【纳米】压电纳米结构诱导干细胞神经分化

Int Immunopharmacol:过敏性鼻炎中桔皮素能够促进T细胞分化

单细胞测序助力发现一类新的脂肪祖细胞,竟藏身于“新器官”?|Science述评
科学家揭示亲代组蛋白遗传影响细胞分化命运

多团队合力构建文昌鱼胚胎细胞分化图谱

专家点评 | 邹康团队在雌性生殖干细胞研究中取得进展

昆明动物所等构建文昌鱼胚胎单细胞水平的细胞分化谱系
Cell Reports:构建文昌鱼胚胎单细胞水平的细胞分化谱系

研究揭示调控iNKT细胞分化终末成熟的分子机制