科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-27
来源:ScienceAAAS
中科院青促会特邀评论员 季晨博
(南京医科大学附属妇产医院)
评述论文:Identification of a mesenchymal progenitor cell hierarchy in adipose tissue(Science 26 April 2019)
肥胖已经成为最严重的公共卫生问题之一。肥胖问题的核心是机体将多余能量以脂肪形式储存于白色脂肪细胞、导致体内白色脂肪组织异常积聚和分布,进而引起全身能量代谢紊乱及各系统并发症。理解白色脂肪组织在肥胖发生发展中的生理病理机制对于肥胖的防治尤为重要。
白色脂肪组织的基本功能是储存体内多余能量,主要通过白色脂肪组织扩增实现。在食物匮乏的岁月,这种能力会帮助人类抵抗饥饿和寒冷;而在食物易获取、能量摄入过量的当代社会,这种能力可以帮助机体免受高血脂、异位脂肪积聚等影响。白色脂肪组织并不能简单的讨论好与坏,缺乏或过多均能对健康产生影响,白色脂肪组织过少或脂肪组织储存脂肪的能力发生障碍,就极易引起高血脂、胰岛素抵抗及糖尿病等代谢疾病,比较典型的如各种原因导致的脂肪营养不良或脂肪萎缩(lipodystrophy)患者;白色脂肪过多积聚会导致脂肪组织发生结构与功能的变化,如纤维化及慢性炎症,从而导致各种代谢并发症。
白色脂肪扩增表现为脂肪细胞数量的增加及体积增大,与脂肪细胞分化(Adipogenesis或 Adipocyte differentiation)有关,即将脂肪的前体细胞分化为成熟的脂肪细胞。而有关脂肪细胞的具体起源,现在所知还很少。目前通常将脂肪血管基质细胞(Stromal vascular fraction,SVF或Stromal vascular cells,SVCs)、脂肪源间充质干细胞(Adipose-derived Mesenchymal Stem Cells)用于脂肪细胞分化的研究,而这些细胞实际上仍然是异质性较强的细胞群。
本期Science报道了一项探讨脂肪细胞来源的研究,该研究利用10 × Genomics单细胞测序技术,将12天的小鼠腹股沟脂肪(该时间节点脂肪组织正快速形成)来源的SVCs大体分为10组细胞亚群(图1),其中有三组细胞在SVCs中具有较高的比例,且均表达经典脂肪祖细胞标志(Canonical mesenchymal progenitor markers),如Cd34,、Pdgfra、Ly6a(Sca1)和Thy1 (Cd90),三组细胞分别为:
组1——Dpp4+细胞亚群:特异表达Dpp4(编码二肽基肽酶-4), Wnt2, Bmp7, and Pi16但不表达成熟脂肪标志基因;
组2——ICAM1+细胞亚群:表达Icam1和Dlk1(Pref1),以及成熟脂肪细胞标志基因Pparg、Fabp4和Cd36;
组3——CD142+细胞亚群:特异表达Clec11a、Fmo2和F3/CD142。
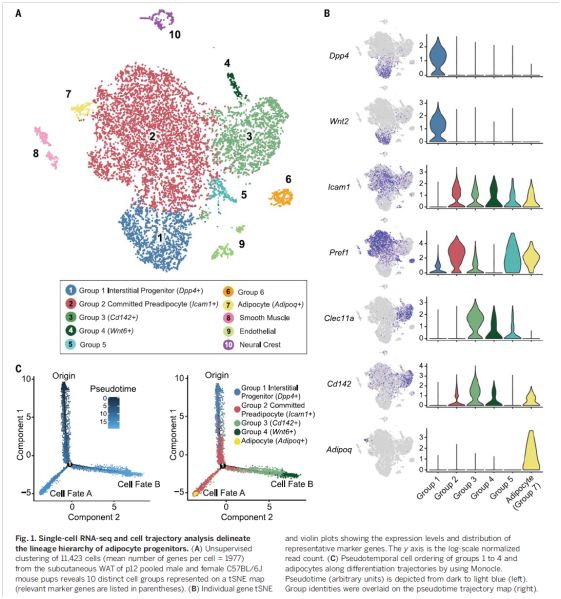
图1. 小鼠白色脂肪SVCs的细胞亚群分析
该研究主要发现:
新发现脂肪细胞的一类起源细胞——Dpp4+亚群细胞:Dpp4+细胞亚群可转变为ICAM1+和CD142+细胞亚群,CD142+与ICAM1+细胞亚群之间可以互相转化(图2);Dpp4+、ICAM1+、CD142+三个亚群细胞在体内均具有较强的成脂能力;Dpp4+、ICAM1+、CD142+三个亚群细胞广泛存在于不同部位脂肪组织(皮下、内脏白色脂肪及棕色脂肪)、不同年龄的脂肪组织(12d及成年期小鼠),也是人脂肪组织SVCs重要组成;
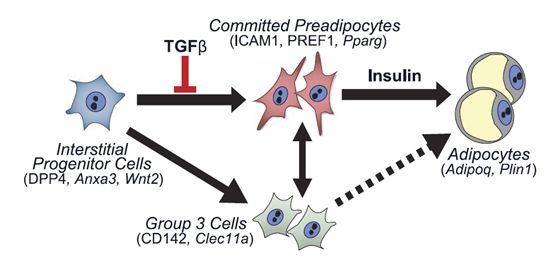
图2. 三个细胞亚群关系模式图
TGFβ通路是Dpp4+细胞群的成脂定向分化的重要调控者:Dpp4+细胞亚群相对其他亚群具有更强的增殖能力和多向分化能力,但体外培养条件下脂肪分化能力较弱,而ICAM1+、CD142+细胞在体外培养条件下,给予胰岛素刺激即可高效分化为成熟脂肪细胞;体外培养条件下,Dpp4+细胞亚群给予TGFβ刺激几乎完全抑制其向脂肪细胞分化,而给予TGFβ受体抑制剂SB431542可显著促进其向脂肪细胞分化;
肥胖可显著影响内脏脂肪组织内细胞亚群的构成与功能:内脏脂肪的Dpp4+细胞亚群比例减少、CD142+细胞亚群比例增加、ICAM1+与CD142+亚群细胞的增殖与分化能力均显著减弱;
奇妙的是,DPP4+细胞亚群主要存在于间质组织(Interstitium)。间质组织是位于皮肤之下及各种器官组织内,相互连接成一种充满液体的网状结构,可能是体内最大的器官。
该研究给我们带来的一些启示:
1、脂肪组织在体内几乎可以无处不在,而间质组织(Interstitium)也是一个连通全身的“新器官”,因此脂肪与间质组织的关系值得关注,未来有可能针对间质组织的储存、运输功能开发肥胖的防治手段。
2、基于脂肪细胞为靶标的肥胖防治研究,未来需要逐步精确到具体的细胞亚群,如促进或抑制特定亚群来控制肥胖及其并发症。
3、DPP4+细胞亚群的标志物DDP-4(二肽基肽酶-4)本身也是一个糖尿病治疗靶点,它能特异性水解多肽或蛋白质N末端的Xaa-Pro或Xaa-Ala二肽,如胰高血糖素样肽1(GLP-1)。DPP-4抑制剂已被用于2型糖尿病的临床治疗,并发现不仅可以降糖,还具有改善血脂、降低内脏脂肪、改善胰岛素抵抗的效果。基于DPP4+细胞亚群是脂肪细胞重要起源的发现,DPP-4抑制剂的药理可能并不是那么简单。
4、脂肪组织内还存在多种炎症细胞(如巨噬细胞),在肥胖致代谢综合征中扮演重要作用,该研究未涉及到相关内容。后续如通过单细胞测序鉴定脂肪组织内不同炎症细胞亚群,并探讨其与不同亚群脂肪细胞之间相互作用关系,对理解肥胖的发生发展具有重要意义。
5、DPP4+细胞亚群体内和体外在脂肪分化能力上的差别,说明除了TGFβ通路之外还有很多其他影响脂肪分化方向的调控因素。
6、该研究中还发现一小群无脂滴积聚但表达成熟脂肪标志的特殊细胞群(原文中Group 7),这类细胞群是新分化的脂肪细胞还是具有特殊作用也值得关注。
7、该研究发现的CD142+细胞亚群,基因表达特征与之前Nature报道的脂肪组织中Aregs亚群细胞相似,但功能上与之前报道“Aregs细胞本身成脂分化很弱,且在脂肪SVCs群体中扮演抑制脂肪分化作用”相比,CD142+细胞表现为较强的脂肪分化能力。个人推测CD142+细胞亚群或Aregs亚群细胞可能是一个不太稳定的群体。
8、该研究选用的10× Genomics单细胞测序技术适用于体积较小的SVCs,而对于体积较大的成熟脂肪细胞,现有单细胞测序技术的应用仍存在较大的限制。
述评人简介季晨博博士,副教授、副主任医师,南京医科大学附属妇产医院(南京市妇幼保健院)研究中心主任;主要研究方向:肥胖的临床与基础研究,重点关注白色脂肪的分化与棕色化、棕色脂肪分化与激活等。
来源:Science-AAAS ScienceAAAS
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDY3NzQ2Mg==&mid=2247486918&idx=3&sn=8b5412404eca1b36dc335a7343aa8f1a&chksm=eb11267fdc66af69a1dc0d5162b2d5cfb04c92e6fe78cdbcc8fa511103c68e03e3f1bdebfcbe&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

细胞脂肪如何“防感冒”?
肥胖只是因为吃的多吗?
欺骗脂肪细胞 挟持肠道菌群 为了作恶癌细胞也是蛮拼

Science :细胞分化过程中状态图谱与细胞命运图谱

肉桂香料可以燃烧脂肪细胞

脑洞大开!将癌细胞变成了脂肪细胞?这群科学家为抗癌另辟蹊径

新突破│小脑奥秘知多少:单细胞基因表达谱揭示小脑细胞分化机制
荧光变色技术“看清”细胞分化发育轨迹
营养与健康所等发现脂肪前体细胞分化命运的重要调控机制

同日两篇《细胞》:凭啥我比别人胖20斤?大型研究揭示肥胖背后的新奥秘