科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-26
来源:BioArt
所有生命形式的传承都离不开基因组DNA的精确复制,而这一机制是由一系列蛋白质形成的复合物,即复制体(replisome)来精确调控完成的【1】。在细胞内,两条DNA单链(ssDNA)通过碱基互补作用而形成双链DNA分子(dsDNA)。在DNA复制开始前,复制体利用环状解旋酶来打开dsDNA,这一过程需要水解ATP消耗能量, 并在DNA模板单链和双链连接的地方形成复制叉结构(replication fork)。复制体以ssDNA为模板合成两条新的dsDNA作为两个子细胞的遗传密码。但复制体遇到DNA损伤时会解体,待DNA修复后重新形成而完成整个基因组的复制【2】。
真核生物细胞的解旋酶CMG是由6个类似的亚基(Mcm2-7)形成一个杂六聚体环状结构,再通过紧密结合其它辅助因子(Cdc45,GINS)形成的蛋白质复合物【3】。此前的研究证明CMG能够包绕dsDNA后形成一个闭环结构并在DNA上来回移动。在细胞周期开始后,CMG解旋酶在复制起点(origin of replication)上成对形成。待DNA复制起始时,两个解旋酶使dsDNA解链融化,转变为ssDNA并募集剩余的复制体因子以开始基因组的双向复制。CMG在复制过程中,闭环结合在ssDNA上并持续地解开模板DNA双链螺旋结构。但目前对于CMG解旋酶是如何由闭环结合dsDNA的状态转变成结合ssDNA的过程,以及CMG如何介导DNA修复后的复制重启还是一片未知。
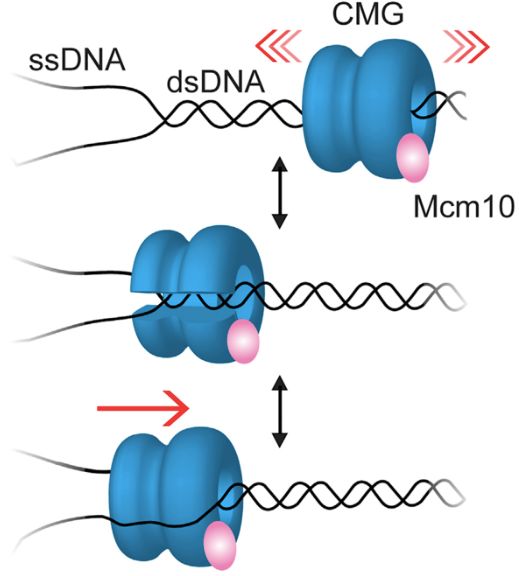
图1:CMG解旋酶能够在单链和双链DNA之间切换。
2019年7月25日,来自洛克菲勒大学的刘诗欣和Michael O’Donnell实验室合作在Cell杂志上发表了长文文章Replication Fork Activation Is Enabled by a Single-Stranded DNA Gate in CMG Helicase,报道了CMG解旋酶在单链和双链DNA之间的结合切换中存在一种类似“门控”的机制【4】。这一重要发现通过重组表达一系列带有荧光标记的真核DNA复制相关蛋白质,并使用最先进的能结合双光镊、多色荧光共聚焦显微镜和自动微流控系统多种先进技术的单分子仪器(C-Trap)来完成研究的。

图2:C-Trap 工作示意图。
借助这台先进的仪器,研究人员可以在一小块微流通池中分别注入含有不同实验材料的溶液,将珠子、DNA及不同蛋白进行体外组装和DNA复制的动态研究。首先研究人员将单个DNA分子锚定在两个由激光束捕获控制(光阱)的珠子之间,并通过光阱控制两个珠子的移动而拉伸DNA以观察荧光标记的复制体沿着DNA的移动过程;然后通过进一步增加两个珠子之间的距离来增强拉力,一部分dsDNA能够被打开形成两股ssDNA,从而在体外形成DNA复制叉结构。同时,研究人员能够使用荧光标记的ssDNA结合蛋白标记融化区域,从而能直观地区分ssDNA和dsDNA区域。这样,不同荧光染料标记的复制体成份如CMG解旋酶在不同DNA区域移动时就能被实时动态跟踪,并能结合多维测量数据以分析单分子水平的分子相互作用。
利用这项尖端技术,研究人员首先发现CMG在辅助分子Mcm10的介导下能够结合单链DNA并朝单链DNA的5’端方向移动,且常常停留在单链和双链DNA的分叉连接处(即复制叉),甚至能够结合DNA聚合酶和激活DNA复制。接着研究人员发现当CMG-Mcm10不能结合到DNA聚合酶时,CMG也不再锚定在复制叉位置,而是可以沿着复制叉附近dsDNA快速扩散移动;同样在dsDNA上移动的CMG也可以重新回到复制叉位置,结合ssDNA并能重新形成有功能的复制体合成新的DNA。研究人员把CMG这种在结合双链DNA和复制叉处单链DNA时表现出不同功能状态的内在转变调节为“门控(gating)”机制。这一发现可以解释CMG在Mcm10的介导下,在复制起始过程中如何从dsDNA弥散移动的状态转变为锚定在单链复制叉的状态。此外,CMG中新发现的“门控”机制也为DNA复制重启提供了一种可能机制,CMG的来回移动寻找邻近的复制叉可以介导复制体在 DNA损伤修复后重新形成。
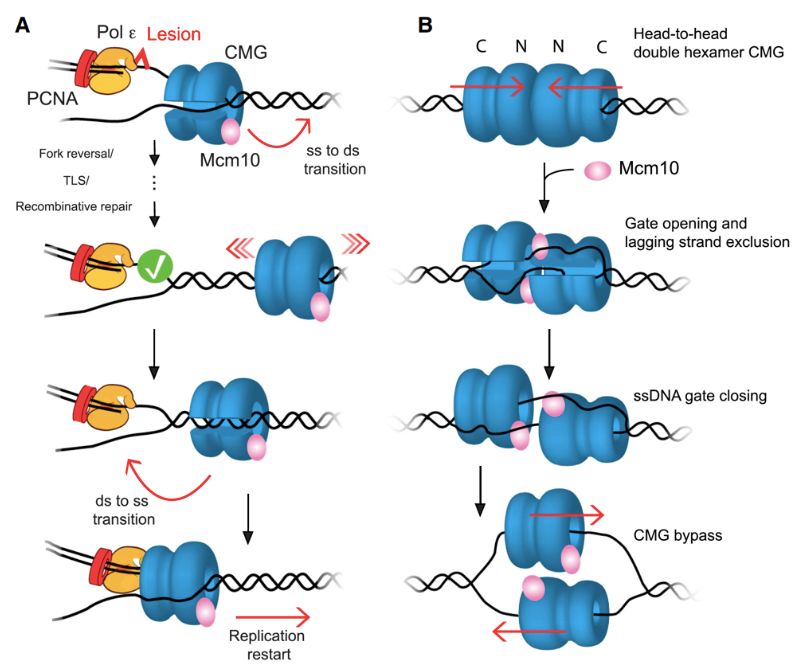
图3:CMG“门控”机制的生物学意义。
综上,该论文不仅发现了解旋酶CMG门控在DNA复制起始和重启时的重要作用,而且也展示了将单分子技术用于研究DNA-蛋白质相互作用的威力。
原文链接:
https://doi.org/10.1016/j.cell.2019.06.032
参考文献
1. Alberts, B. (2003). DNA replication and recombination. Nature 421, 431-435.
2. Amunugama, R. et.al. Replication fork reversal during DNA interstrand crosslink repair requires CMG unloading. Cell Rep. 23, 3419-3428.
3. Burnham, D.R. et.al. The mechanism of DNA unwinding by the eukaryotic replicative helicase. Nat.Commun.10, 2159.
4. Wasserman Michael R., Schauer Grant D., O’Donnell Michael E. and Liu Shixin, Replication fork activation is enabled by a single stranded DNA gate in CMG helicase, Cell 178, July 25 (2019)
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473199&idx=1&sn=41cfbf3a942aeb65bb8673de65c978c3&chksm=84e214dbb3959dcd5d2210ef0ee41653f59658b723553cd37bc80e1ebdf94a7e89d7586ff0b1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【大师讲堂】解读生命密码:DNA的复制历程

科学家首次揭开DNA复制的秘密
有关如何读取和复制DNA的新研究

DNA复制体结构和工作原理首次被揭示

科学家探索物种间DNA组成多样性背后的奥秘
演化:“最奇怪动物”身份揭秘

人造碱基能像天然碱基参与DNA复制

自然中不存在的蛋白质也能人造了!撼动材料医药界

《Cell》更强劲的DNA修复=长寿
【大师讲堂】解读生命密码:DNA的复制历程