科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-27
来源:BioArt
组织的功能需要借助不同细胞之间的相互协作才得以实现,这其中包括上皮细胞,免疫细胞,基质细胞等等,而任何一类细胞的功能失调都可能导致疾病的发生。事实上,为了维持机体的稳态,不同的细胞之间往往存在补偿作用,这也使得对于某些疾病而言,很难定位到某一细胞种类,从而找到具体的发病机制。溃疡性结肠炎(ulcerative colitis, UC)就是一个很好的例子【1】。
溃疡性结肠炎是炎症性肠病(inflammatory bowel disease, IBD)的一种。目前已知的IBD致病风险因子所涉及的通路包括,先天及获得性免疫,胃肠道屏障以及病原体感受和响应系统。事实上,尽管GWASs(Genome-wide association studies)分析已经找到了其中很多的致病风险因子【2】,但是没有搞清楚的是,这些致病因子究竟和哪些细胞种类和信号通路相关?
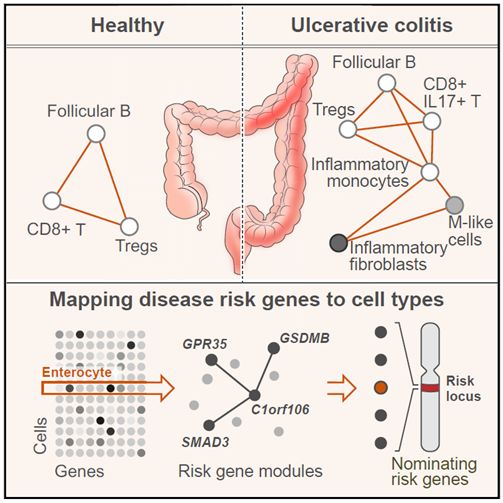
2019年7月25日,来自哈佛大学博德研究所的Mark J.Daly教授及其合作者们在Cell上以resource形式发表了题为Intra- and Inter-cellular Rewiring of the HumanColon during Ulcerative Colitis 的研究。他们对分别来自健康人群和UC患者肠粘膜组织的共366,650个细胞进行了单细胞RNA测序(Single-cell RNA sequencing, scRNA-seq),揭示了特定风险基因所对应的细胞种类和信号通路。

作者一共从12例正常人群和18例UC患者的肠镜检查过程中共收集了68例活体组织样品,并且成功利用单细胞测序的技术手段获取了366,650个高质量的转录组数据。为了探究UC患者由健康状态向慢性炎症的转变过程,作者在UC患者组织样本中分别选取了临近溃疡处的正常组织(non-inflamed)和溃疡或发炎组织(inflamed),以此与健康人群的组织(healthy)进行比较。此外,为了避免结肠组织不同区域的异质性,作者在每一组别中都观察了两处不同区域的结肠组织(距离相差1-2cm)。
最后,作者对这一方法进行了验证。他们发现:炎症相关基因的表达的确在健康组织、未发炎组织和发炎组织中依次上调。这说明,他们收集的这三组不同组织样本可以很好地反映UC病程的进展,并且可以用于后续的研究。
得到这366,650个单细胞转录组数据之后,作者对这些组织样本的细胞组成,基因表达,细胞之间的相互作用以及炎症性肠病(IBD)风险基因在特定细胞种类和通路的分布情况进行了一个总体评估。其主要结论有如下几点:
作者一共鉴定到51种细胞,主要分为上皮细胞(epithelial),基质细胞(stromal),免疫细胞(immune cell)三大类。
首先,作者惊奇的发现,尽管M细胞(黏膜免疫系统中一种特化的抗原转运细胞,散布于肠道黏膜上皮细胞间)在正常结肠组织几乎检测不到,但在炎症结肠组织中却显著增加,并且在细胞间的相互作用中扮演重要角色。与此同时,M细胞中GWASs找到的IBD风险基因的表达水平也是最高的。
此外,从健康组织到UC患者的未发炎组织再到发炎组织,CD8+IL-17+T细胞和Tregs细胞数量均显著上升,并且是细胞因子IL-17和TNF的主要来源。同时作者发现,TNF+ Treg细胞可能是决定IBD病程发展以及导致TNF抗体抵抗的一个重要细胞类型,并且对于CD8+ T细胞的可塑性调节也很关键。
有意思的是,在某些未知的髓细胞和基质细胞中,OSM(Oncostatin M,一种多效性的细胞因子,属于IL-6组的细胞因子)信号通路也可能是导致TNF抗体抵抗的诱因之一。因为作者发现OSM与TNF的功能十分类似,因此一种可能的解释是OSM可以协同增强TNF的作用,从而导致TNF抗体抵抗。同时,作者发现对于TNF抗体没有响应的组织样本中,一类炎症相关的成纤维细胞(inflammation associated fibroblasts,IAFs)高度富集,这意味,IAFs可以作为一个非常理想的生物标志物用于评估IBD对于TNF抗体的耐药性。
除此之外,作者还发现IAFs特异性的表达IL-11,一个已经报道在小鼠体内可以调控纤维化的细胞因子,并且很有可能在人里发挥同样的功能。更有趣的是,IAFs不仅表达很多CAFs的标志物,并且很多IAFs的标志物在结肠癌中也是高表达的。这提示,IAFs在结肠的炎癌转化过程中可能扮演重要角色。
综上,作者的这项工作不仅鉴定出在IBD这个疾病模型中一些已知的风险基因在不同细胞类型和信号通路的分布,同时为今后利用单细胞测序技术去寻找疾病的成因以及治疗方法提供了一个很好的技术框架。
原文链接:
https://doi.org/10.1016/j.cell.2019.06.029
参考文献
1. Xavier,R.J.,andPodolsky,D.K. (2007). Unravelling the pathogenesis of inflammatory boweldisease. Nature 448, 427–434.
2. Liu,J.Z., et al.(2015).Association analyses identify 38 susceptibility loci for inflammatory boweldisease and highlight shared genetic risk across populations. Nat. Genet. 47,979–986.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473229&idx=2&sn=40fc26c2f6b736e650b7356d33fd3ec9&chksm=84e21439b3959d2f08376a448b6134bded05a98b370da34c87af3b1b051e455372fb57b12fff&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Gastroenterology:依曲西莫德2毫克或可有效治疗溃疡性结肠炎

NC:溃疡性结肠炎体外研究新模型

华中大科研团队发现RNF186导致溃疡性结肠炎的分子机制
额外补充姜黄素可改善轻中度溃疡性结肠炎患者的疾病活动性

安倍晋三辞去首相职务,溃疡性结肠炎真的是不治之症吗?
Science Immunology:单细胞测序揭示溃疡性结肠炎的特征

听说喝酸奶能减少结肠癌前病变,是真的吗?这事得这么看……

利用果蝇发现结肠直肠癌患者的新疗法|Science Advances

BMJ:压力性尿失禁患者的手术干预

每天20个核桃,就可以有效预防溃疡性结肠炎