科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-28
来源:BioArt
原标题:Cell Reports | 马永超组报道m6A 新型Reader促进甲基化RNA细胞核输出的功能
在已发现的150种RNA化学修饰中,m6A(N6-adenosine)是丰度最高、功能最重要的一种【1】。m6A是一种可逆的修饰。以METTL3(methyltransferase-like 3)和METTL14(methyltransferase-like 14)为核心组成的复合体“Writers”对RNA进行甲基化修饰, 这些甲基化可以被YTHDF1,2,3(YTH domain family1,2,3) 等 “Reader” 识别,同时m6A可以被作为“Eraser”的FTO和ALKBH5(AlkB homolog 5)等蛋白清除【1】。近几年的研究表明m6A修饰可以调控RNA的稳定性、定位和翻译等,是影响RNA代谢和功能的关键调控之一【2】。但m6A在体内的功能和作用调控机制仍不明确。
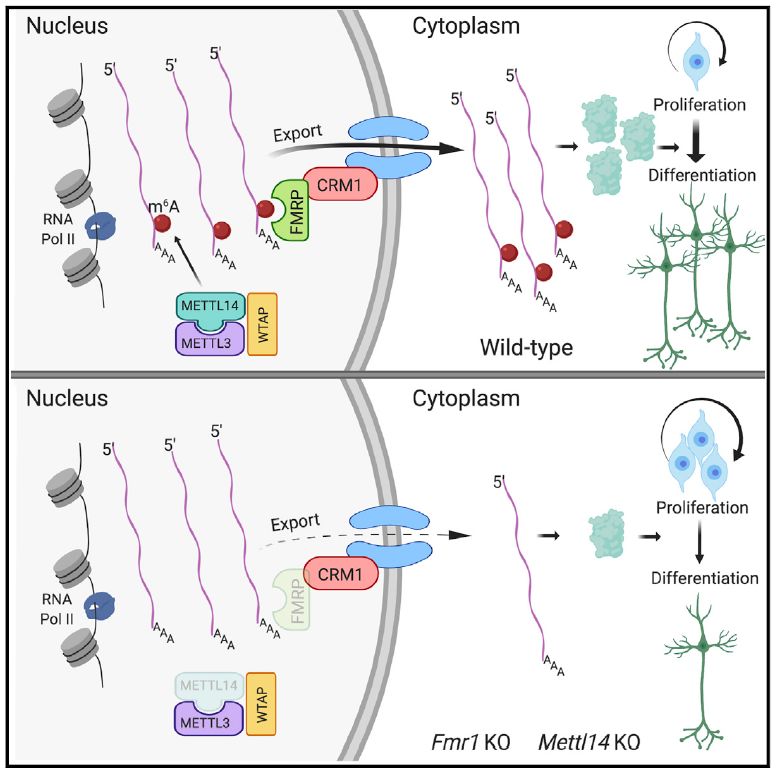
2019年7月23日,美国西北大学(Northwestern University)的Yongchao Ma(马永超)课题组在Cell Reports发表了题为FMRP Modulates Neural Differentiation through m6A-Dependent mRNA Nuclear Export的研究成果,报道了FMRP作为m6A的一个reader,可以促进甲基化RNA的细胞核输出,调控神经细胞分化。

脆性X智力低下蛋白FMRP由Fmr1基因编码,其突变会导致脆性X染色体综合征。FMRP是一个RNA结合蛋白,具有核定位序列(nuclear localization sequence,NLS)以及核输出序列(nuclear export sequence,NES),在细胞质和细胞核都有分布,调控基因表达【3,4】。
在Fmr1敲除(KO)小鼠中,作者发现胚胎期神经祖细胞的细胞周期进展延迟,分化缺陷。在出生后,敲除小鼠仍保留有可增殖的神经祖细胞。这些发现和和University of Pennsylvania的Hongjun Song实验室之前报道的Mettl14 条件敲除(conditional KO)小鼠的神经系统发育表型十分相似【5】,提示FMRP和m6A在体内存在功能联系。
由于FMRP在细胞质和细胞核中都有分布,因此作者提出假设,FMRP在甲基化RNA的细胞核输出中发挥作用。通过对Fmr1 WT和KO神经前体细胞(neural precursor cells,NPCs)的细胞核RNA进行RNA-seq,同时和m6A-seq的数据比对,作者分析被m6A修饰的FMRP靶标基因,发现它们在Fmr1 KO的细胞核中富集,并且Gene Ontology分析显示这些基因与细胞分化、神经发育以及胚胎发育等过程相关。选取富集在Notch和Hedgehog通路中几个基因检测,作者发现它们在细胞内整体表达水平相同,但在Fmr1敲除后,细胞核内的RNA含量却显著升高,提示这些RNA滞留在细胞核内,输出出现问题。与此相似,在Mettl14敲除后,这些基因在细胞核内RNA水平也相对较高。这些结果表明细胞核输出既需要FMRP,又需要m6A修饰。随即作者也利用纯化的FMRP蛋白和生物化学和生物物理学手段证明了m6A修饰可以显著增强RNA和FMRP的结合。最后作者进一步证明了这一细胞核输出过程是细胞核输出蛋白CRM1(exportin 1)和FMRP相互作用介导完成的, 提供分子水平的机制。
这一研究由Northwestern University 的Yongchao Ma课题组, University of Pennsylvania的Hongjun Song和The University of Chicago的Chuan He实验室合作完成,表明了FMRP可以特异地结合被m6A修饰的RNA,通过与CRM1相互作用,促进这些RNA的细胞核输出,调控基因表达,进而影响神经干细胞和神经系统发育。
原文链接:
https://doi.org/10.1016/j.celrep.2019.06.072
参考文献
1. Shi, H., J. Wei, and C. He, Where, When, and How: Context-Dependent Functions of RNA Methylation Writers, Readers, and Erasers. Mol Cell, 2019. 74(4): p. 640-650.
2. Roignant, J.Y. and M. Soller, m(6)A in mRNA: An Ancient Mechanism for Fine-Tuning Gene Expression. Trends Genet, 2017. 33(6): p. 380-390.
3. Richter, J.D., G.J. Bassell, and E. Klann, Dysregulation and restoration of translational homeostasis in fragile X syndrome. Nat Rev Neurosci, 2015. 16(10): p. 595-605.
4. Eberhart, D.E., et al., The fragile X mental retardation protein is a ribonucleoprotein containing both nuclear localization and nuclear export signals. Hum Mol Genet, 1996. 5(8): p. 1083-91.
5. Yoon, K.J., et al., Temporal Control of Mammalian Cortical Neurogenesis by m(6)A Methylation. Cell, 2017. 171(4): p. 877-889 e17.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473260&idx=5&sn=cb72cd354c2014b6a450987f1e76978d&chksm=84e21418b3959d0e8f33e3af748f192fcd60ab97530b8954339bbdcaa5a2d3dc5bf70e48c488&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

细胞核中暗藏被忽视的分子机制
科学家揭示细胞核与衰老关系

细胞核中暗藏被忽视的分子机制
失去细胞核的细胞在3D环境中举步维艰

生物钟调控代谢新方式揭示
Eschemoser亚甲基化反应

超强甲基化,此中有真意:一种新型甲基化试剂问世
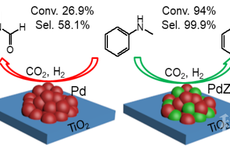
PdZn/TiO2催化剂上CO2作为甲基化试剂的N-甲基化反应
蛋白复合物Paf1:携带基因致病的奥秘
甲基化过程