科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-12
来源:iNature
2019年8月8日,复旦大学基础医学院聚合物分子工程国家重点实验室占昌友团队在Nature Communications上发表题为“Brain-targeted drug delivery bymanipulating protein corona functions”的研究论文,该研究利用SP修饰的脂质体(SP-sLip),旨在精确调节形成的蛋白质corona的组成和功能。

靶向给药系统(TDDS)越来越受到关注,可以达到更好的治疗效果和减少副作用。有许多TDDS正在进行临床试验,然而TDDS的临床翻译相对较慢。迄今为止已经进行了大量努力来鉴定高亲和力配体,进入血流后,TDDS表面形成的蛋白质电晕可能严重影响靶向产量并诱导不利的生物分布。除了大量惰性(或具有未知功能)血浆蛋白外,还有许多功能性的吸收在药物递送系统的表面上。
因此,通过在纳米表面上保留靶血浆蛋白的功能,corona介导的靶向可以为特定的药物递送提供新的推动力。已经在多种药物递送系统表面形成的蛋白质冠状病毒中发现了可交换的载脂蛋白(如ApoA,C和E),它们可以指导脂质通过淋巴和循环系统的转运。一些可交换的载脂蛋白(ApoA1和ApoE)可以通过受体介导的转胞吞作用跨越血脑屏障(BBB)。然而,很少有报道,在血液中吸收这种载脂蛋白后,普通的药物传递系统(没有脑靶向配体的修饰)会穿透BBB。
研究人员用短肽实现了corona介导的脑靶向,用于建立模式结合可交换的载脂蛋白。在脂质体进入血流后,载脂蛋白的受体结合结构域适当地暴露在脂质体表面上。体内重新设计的脂质体显示出高的脑靶向能力并有效地促进脑癌靶向治疗。 并且研究人员证实了SP-sLip能够吸收人体血液中的ApoE并保持其与rhLRP1的结合亲和力。将SP-sLip和sLip与健康人血浆孵育1小时,并进一步与I125放射性标记的rhLRP1一起孵育1小时。
通过离心分离脂质体表面上吸收的放射性标记的rhLRP1,并使用γ计数器测定。在与人血浆孵育后,SP-sLip可以与rhLRP1有效地相互作用,表明从人血浆中吸收的ApoE保留了受体结合活性。 SP也在PLGA纳米颗粒的表面上被修饰,其也广泛用作化学治疗剂的纳米载体。在与人血浆孵育后,SP-PLGA NP可与rhLRP1相互作用。这些结果表明SP修改可以作为TDDS设计的平台。
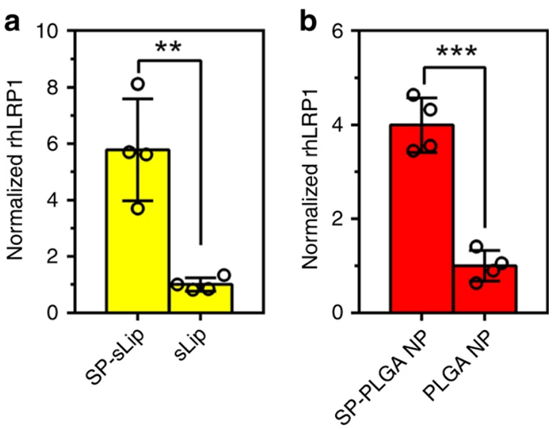
人血浆中形成的蛋白质中ApoE功能的表征
蛋白质电晕是靶向药物递送系统的主要障碍,严重影响靶向产量并指导不利的生物分布。通过精确操纵纳米表面上功能性血浆蛋白的相互作用模式,电晕介导的靶向为特定药物递送提供了新的推动力。该研究中,生物启发脂质体(SP-sLip)是通过用Aβ1-42衍生的短无毒肽修饰脂质体表面而开发的,该肽与可交换载脂蛋白的脂质结合结构域特异性相互作用。
SP-sLip吸收血浆载脂蛋白A1,E和J,从而暴露载脂蛋白的受体结合域以实现脑靶向递送。与普通脂质体相比,载有阿霉素的SP-sLip(SP-sLip / DOX)显示出脑分布和抗脑癌作用的显着增强。 SP-sLip保留吸收的人血浆ApoE的功能,并且corona介导的靶向策略在SP修饰的PLGA纳米颗粒中起作用。该研究可能为促进靶向给药系统的临床转化铺平了新的途径。
原文链接:
https://www.nature.com/articles/s41467-019-11593-z
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247503478&idx=7&sn=a7c985d872fd5cae3b2326c8a24b96ad&chksm=fce6bda9cb9134bf993c240200df6379d72eaa7dbb8b15374af0383d5ee75a64fd9d7e062303&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
载脂蛋白AⅡ
血清载脂蛋白测定

复旦大学实现高效脑靶向药物递送
载脂蛋白E基因分型
血清载脂蛋白CII测定

JAMA:美国青少年血脂水平变化研究

Nature Communications:复旦大学实现高效脑靶向药物递送
血清载脂蛋白测定

复旦大学占昌友研究员团队在脑靶向脂质体药物设计上取得新进展
复旦大学占昌友团队在脑靶向脂质体药物设计上取得新进展