科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-14
来源:BioArt
溶酶体是细胞降解循环生物大分子物质的重要细胞器。它接收来自包括吞噬等多种囊泡运输途径转运的货物。降解后,氨基酸、糖、核苷酸等生物大分子经由溶酶体膜上转运蛋白运送至胞质中,供细胞再利用。而溶酶体需要经历再形成的过程维持其正常的稳态平衡。
近期,细胞生物学著名期刊The Journal of Cell Biology (JCB) 2019年第8期发表了云南大学生命科学中心生命科学学院杨崇林教授实验室的研究论文,题目是The amino acid transporter SLC-36.1 cooperates with PtdIns3P 5-kinase to control phagocytic lysosome reformation。该项研究结果以Article形式在线发表,并被选为封面文章。

JCB封面:吞噬溶酶体再形成的电镜图片

在微分干涉显微镜下,线虫胚胎细胞发生凋亡后呈现出特殊的纽扣状突起形态。杨崇林实验室通过正向遗传学筛选,获得了多个凋亡细胞呈凹坑状的突变体,经克隆发现是由于slc-36.1基因功能缺失突变导致。SLC-36.1蛋白在人类中的同源物是中性氨基酸转运蛋白SLC-36A1。SLC-36.1定位在细胞质膜和溶酶体膜上,而且它的氨基酸转运活性对于其功能是必须的。研究者用绿色荧光蛋白标记溶酶体膜蛋白LAAT-1,用红色荧光蛋白标记溶酶体基质蛋白NUC-1,在荧光显微镜追踪溶酶体在生理条件下的变化过程。在野生型线虫的胚胎中,随着吞噬溶酶体不断伸出丝状结构,并显示有新的溶酶体产生,而吞噬溶酶体的体积不断缩小并最终消失。但是,在slc-36.1突变体的胚胎中,吞噬溶酶体出丝的次数明显减少,并且吞噬溶酶体的体积在很长时间内都保持不变(下图)。因此,SLC-36.1对于溶酶体从吞噬溶酶体上再形成的过程是必需的。
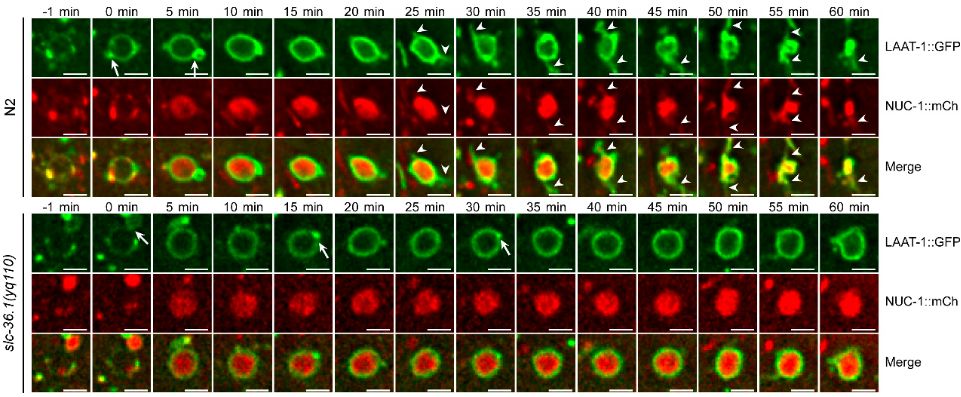
SLC-36.1为溶酶体从吞噬溶酶体上再形成所必需
该研究还发现PPK-3功能缺失同样会阻碍溶酶体从吞噬溶酶体上再形成。PPK-3是磷脂酰肌醇-3-磷酸激酶,能够催化磷脂酰肌醇-3-磷酸继续磷酸化,生成磷脂酰肌醇-3,5-二磷酸,已知磷脂酰肌醇-3,5-二磷酸对于膜分裂起着重要作用。进一步的研究表明,SLC-36.1直接与PPK-3相互作用,形成复合体,协同作用发挥调控作用。研究还发现,在溶酶体从自噬溶酶体上再形成的过程中,SLC-36.1-PPK-3复合物也发挥了调控作用。

SLC-36.1-PPK-3复合物调控溶酶体再形成的模式图
综上所述,本项研究提供的实验证据指明了SLC-36.1-PPK-3复合物在吞噬溶酶体/自噬溶酶体的溶酶体再形成过程中起到了至关重要的调控作用。
据悉,云南生物资源保护与利用国家重点实验室、云南大学生命科学中心及生命科学学院为本研究的第一单位。实验室甘启文博士为本文第一作者,国家杰出青年基金获得者杨崇林教授为通讯作者。
原文链接:
http://jcb.rupress.org/content/early/2019/06/21/jcb.201901074/tab-article-info?versioned=true
专家点评
史岸冰(华中科技大学同济医学院,教授,国家杰青)
溶酶体是细胞中重要的细胞器,具有生物降解、代谢稳态维持、分泌、营养信号感知及传递等功能。溶酶体功能失调会导致严重的人类疾病,如溶酶体贮积症和神经退行性疾病等 (Yamashiro and Maxfield, 1984)。越来越多的交叉研究显示,溶酶体不仅是通常理解的货物降解细胞器,而且充当了很多重要信号通路的胞内载体,通过与其他细胞器的互做,参与调控了与衰老、发育等多种重要生物学过程 (Melendez et al., 2003, Samuelson et al., 2007)。
细胞中货物来源主要分为三类:细胞外货物、细胞质膜货物、细胞内货物。这些经由内吞、吞噬和自噬进入细胞内囊泡结构的的货物很多会被运送到溶酶体,随后在内吞溶酶体、吞噬溶酶体和自噬溶酶体中的酸性水解酶的作用下被降解 (van Meer and Sprong, 2004)。这一过程是细胞获取营养物质,保持细胞和组织稳态的重要手段。大量货物在溶酶体消化水解过程中,会很快消耗细胞中的溶酶体池。为此,溶酶体需要一个溶酶体降解后再生的过程,以维持胞内溶酶体池的稳态。研究发现,为了满足溶酶体降解的需要,细胞会采取激活TFEB和TFE3(溶酶体和自噬基因的两种转录因子)来增加溶酶体的数量 (Martina et al., 2014)。除此之外,溶酶体重生是维持溶酶体池的另外一个重要途径。最近的一系列研究揭示了溶酶体重生伴随溶酶体降解货物的机制,提出自噬溶酶体重生(ALR)涉及以下过程:磷脂酰肌醇-4,5-二磷酸和网格蛋白(clathrin)介导的自噬溶酶体出芽,KIF5B驱动的膜管沿微管伸长,dynamin介导的原溶酶体膜断裂以及原溶酶体成熟 (Chen and Yu, 2018)。除此之外,磷脂酰肌醇3-磷酸(PI3P)5-激酶PIKfyve和溶酶体钙通道TRPML1是溶酶体重生所必需的调控因子(Bissig et al., 2017)。PIKfyve能够催化生成溶酶体标志性磷脂:磷脂酰肌醇-3,5-二磷酸,进而活化TRPML1以控制溶酶体Ca2 +外流(McCartney et al., 2014)。然而,鉴于在体研究体系的缺乏,学界对货物被降解之后,溶酶体从内吞溶酶体、吞噬溶酶体和自噬溶酶体上再形成的过程和调控机制依然知之甚少。
秀丽线虫是研究细胞凋亡的理想实验材料,由于其细胞器体系及其调控机制高度保守,线虫已被发展成为研究亚细胞结构的高效在体模式系统,学界构建了成熟的专用研究体系,大量荧光融合货物转基因品系 (Sato et al., 2007, Nagai et al., 2002, Chen et al., 2006, Chen et al., 2018) 以及细胞器荧光融合标记蛋白转基因品系被建立 (Chen et al., 2006, Sato et al., 2011, Zhang et al., 2012, Liu et al., 2012)。基于线虫在体研究体系,学界对细胞器相关调控机制开展了一系列遗传学筛选和候选因子机制探索工作,为膜生物学的发展提供了大量活体动物研究证据。杨崇林教授实验室以秀丽线虫为模式体系,经过长期的积累、总结和发展,深入解析了一系列晚期内体和溶酶体形成、吞噬溶酶体再生以及相关疾病的调控机制,在Science、Nat Cell Biol、J Cell Biol、Mol Psychiatry等知名学术期刊上发表了大量重要成果 (Li et al., 2016, Chen et al., 2010, Liu et al., 2017b, Liu et al., 2017a, Wang et al., 2018)。线虫SLC-36.1是哺乳动物SLC36A1-4和LYAAT-1、果蝇Path、酵母AVT4的同源物,属于氨基酸/生长素通透酶超家族成员。
杨崇林实验室在本期JCB发表的工作中,充分利用细胞生物学、遗传学和生物化学手段,通过大量实验证据揭示了此前未被发现的PIKfyve调控溶酶体重生的新机制,展示了SLC-36.1能够直接与PPK-3/PIKfyve相互作用形成复合体,促进氨基酸外运和溶酶体膜出丝,维持溶酶体动态,在溶酶体从自噬溶酶体再生过程中协同发挥调控作用,为进一步理解磷脂酰肌醇代谢酶在溶酶体再生中的功能意义提供了重要的科学证据。此外,该工作还为后续溶酶体相关生理和病理机制研究提供了新的理论线索,例如在组织发育、衰老过程中,mTOR活化及自噬介导吞噬清除凋亡细胞,PPK-3/PIKfyve在其中可能起到关键作用。
参考文献
1. BISSIG, C., HURBAIN, I., RAPOSO, G. & VAN NIEL, G. 2017. PIKfyve activity regulates reformation of terminal storage lysosomes from endolysosomes. Traffic, 18, 747-757.
2. CHEN, C. C., SCHWEINSBERG, P. J., VASHIST, S., MAREINISS, D. P., LAMBIE, E. J. & GRANT, B. D. 2006. RAB-10 is required for endocytic recycling in the Caenorhabditis elegans intestine. Mol Biol Cell, 17, 1286-97.
3. CHEN, D., XIAO, H., ZHANG, K., WANG, B., GAO, Z., JIAN, Y., QI, X., SUN, J., MIAO, L. & YANG, C. 2010. Retromer is required for apoptotic cell clearance by phagocytic receptor recycling. Science, 327, 1261-4.
4. CHEN, D., YANG, C., LIU, S., HANG, W., WANG, X., CHEN, J. & SHI, A. 2018. SAC-1 ensures epithelial endocytic recycling by restricting ARF-6 activity. J Cell Biol, 217, 2121-2139.
5. CHEN, Y. & YU, L. 2018. Development of Research into Autophagic Lysosome Reformation. Mol Cells, 41, 45-49.
6. LI, Y., XU, M., DING, X., YAN, C., SONG, Z., CHEN, L., HUANG, X., WANG, X., JIAN, Y., TANG, G., TANG, C., DI, Y., MU, S., LIU, X., LIU, K., LI, T., WANG, Y., MIAO, L., GUO, W., HAO, X. & YANG, C. 2016. Protein kinase C controls lysosome biogenesis independently of mTORC1. Nat Cell Biol, 18, 1065-77.
7. LIU, B., DU, H., RUTKOWSKI, R., GARTNER, A. & WANG, X. 2012. LAAT-1 is the lysosomal lysine/arginine transporter that maintains amino acid homeostasis. Science, 337, 351-4.
8. LIU, K., XING, R., JIAN, Y., GAO, Z., MA, X., SUN, X., LI, Y., XU, M., WANG, X., JING, Y., GUO, W. & YANG, C. 2017a. WDR91 is a Rab7 effector required for neuronal development. J Cell Biol, 216, 3307-3321.
9. LIU, X., LI, Y., WANG, X., XING, R., LIU, K., GAN, Q., TANG, C., GAO, Z., JIAN, Y., LUO, S., GUO, W. & YANG, C. 2017b. The BEACH-containing protein WDR81 coordinates p62 and LC3C to promote aggrephagy. J Cell Biol, 216, 1301-1320.
10. MARTINA, J. A., DIAB, H. I., LISHU, L., JEONG, A. L., PATANGE, S., RABEN, N. & PUERTOLLANO, R. 2014. The nutrient-responsive transcription factor TFE3 promotes autophagy, lysosomal biogenesis, and clearance of cellular debris. Sci Signal, 7, ra9.
11. MCCARTNEY, A. J., ZHANG, Y. & WEISMAN, L. S. 2014. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance. Bioessays, 36, 52-64.
12. MELENDEZ, A., TALLOCZY, Z., SEAMAN, M., ESKELINEN, E. L., HALL, D. H. & LEVINE, B. 2003. Autophagy genes are essential for dauer development and life-span extension in C. elegans. Science, 301, 1387-91.
13. NAGAI, T., IBATA, K., PARK, E. S., KUBOTA, M., MIKOSHIBA, K. & MIYAWAKI, A. 2002. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol, 20, 87-90.
14. SAMUELSON, A. V., CARR, C. E. & RUVKUN, G. 2007. Gene activities that mediate increased life span of C. elegans insulin-like signaling mutants. Genes Dev, 21, 2976-94.
15. SATO, M., SAEGUSA, K., SATO, K., HARA, T., HARADA, A. & SATO, K. 2011. Caenorhabditis elegans SNAP-29 is required for organellar integrity of the endomembrane system and general exocytosis in intestinal epithelial cells. Mol Biol Cell, 22, 2579-87.
16. SATO, T., MUSHIAKE, S., KATO, Y., SATO, K., SATO, M., TAKEDA, N., OZONO, K., MIKI, K., KUBO, Y., TSUJI, A., HARADA, R. & HARADA, A. 2007. The Rab8 GTPase regulates apical protein localization in intestinal cells. Nature, 448, 366-9.
17. VAN MEER, G. & SPRONG, H. 2004. Membrane lipids and vesicular traffic. Curr Opin Cell Biol, 16, 373-8.
18. WANG, M., TANG, C., XING, R., LIU, X., HAN, X., LIU, Y., WANG, L., YANG, C. & GUO, W. 2018. WDR81 regulates adult hippocampal neurogenesis through endosomal SARA-TGFbeta signaling. Mol Psychiatry.
19. YAMASHIRO, D. J. & MAXFIELD, F. R. 1984. Acidification of endocytic compartments and the intracellular pathways of ligands and receptors. J Cell Biochem, 26, 231-46.
20. ZHANG, D., ISACK, N. R., GLODOWSKI, D. R., LIU, J., CHEN, C. C., XU, X. Z., GRANT, B. D. & RONGO, C. 2012. RAB-6.2 and the retromer regulate glutamate receptor recycling through a retrograde pathway. J Cell Biol, 196, 85-101.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473871&idx=2&sn=9a44a7c9f8f50e25293c96ca2247a9af&chksm=84e219bbb39590ad64c5e004d0298b89edbc65ee127246c832873b0552f3cb30041090246719&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
上海药物所发现miR-30b-5p在细胞核内抑制TFEB介导的溶酶体生成及自噬

科学家发现细胞自噬的关键蛋白机制

JCB | 云南大学杨崇林团队等揭示吞噬细胞和自噬溶酶体形成的分子调控轴
除了禁食,禁水也能启动细胞自噬

eLife:贾瑞博士等报道细胞自噬调节的新机制

活动预告丨“CAAI进校园”系列活动走进电子科技大学
现miR-30b-5p在细胞核内抑制TFEB介导的溶酶体生成及自噬
原位电子显微学探索固体中的离子迁移行为(二)

Cell:科学家从下丘脑“揪出”体重控制基因—SEMA3A
上海药物所发现miRNA能够进入细胞核调控基因转录,影响溶酶体生成及细胞自噬