科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-29
来源:iNature
吞噬细胞对凋亡细胞的清除涉及到含身体的吞噬体的形成、成熟和消化.溶酶体组分的提取在吞噬细胞瘤体消化后的细胞中仍然是鲜为人知的。2019年6月24号,云南大学生命科学学院杨崇林研究团队等人在The Journal of Cell Biology在线发表了题为The amino acid transporter SLC-36.1 cooperates with PtdIns3P 5-kinase to control phagocytic lysosome reformation的研究论文。研究发现氨基酸转运体SLC-36.1是溶酶体在线虫胚胎清除过程中进行溶酶体重组所必需的。此外,PtdIns3P5-激酶PIKfyve的线虫同系物PPK-3的缺失也会导致吞噬溶酶体重组缺陷的巨噬细胞空泡的积累,SLC-36.1和PPK-3的缺失还会导致成年动物自噬溶酶体重组的严重缺陷。总之,该发现提示PPK-3-SLC-36.1轴在吞噬细胞和自噬溶酶体的形成中起着重要作用。

溶酶体是细胞退化、信号感知和信号转导的主要场所。溶酶体功能障碍导致许多人类疾病,包括溶酶体储存疾病和神经退行性疾病。溶酶体接受并降解由自噬、内吞和吞噬产生的细胞内和细胞外物质。这些降解活动迅速消耗细胞内的溶酶体池。因此,溶酶体需要在溶酶体降解后再生,以保持溶酶体池的稳态。为了满足细胞降解的需要,还可以通过激活TFEB和TFE 3这两种溶酶体和自噬基因的转录因子来增加溶酶体的数量。TFEB和TFE 3通过细胞质到细胞核的易位促进溶酶体和自噬基因的转录。
最近的研究揭示了溶酶体重组的机制,伴随着溶酶体自噬和内吞货物的降解。自体溶酶体的溶酶体重组,也称为自噬溶酶体重组(ALR),涉及磷脂酰肌醇4,5-二磷酸和克拉特林介导的膜在自身溶酶体上的萌发,KIF5B驱动的微管延伸,动力依赖的原溶酶体断裂,最终促进溶酶体成熟。Spinster是一种溶酶体糖转运体,在长期饥饿的细胞中对ALR也是必不可少的。内切细胞溶酶体的重组是一个ATP依赖的过程,这也需要溶酶体酸化和溶小体内Ca2+。此外,细胞内溶酶体的改造还需要3-磷酸磷脂酰肌醇(PtdIns3P)5-激酶PIKfyve和溶酶体钙通道TRPML 1。PIKfyve生成3,5-二磷酸磷脂酰肌醇,激活TRPML 1以控制溶酶体Ca~(2+)外流。值得注意的是,PIKfyve、TRPML 1和mTOR可调节吞噬体和内泡收缩,表明这些因素对溶酶体在吞噬小体上的再生很重要。尽管如此,吞噬溶酶体重组(PLR)的机制仍然很难理解。
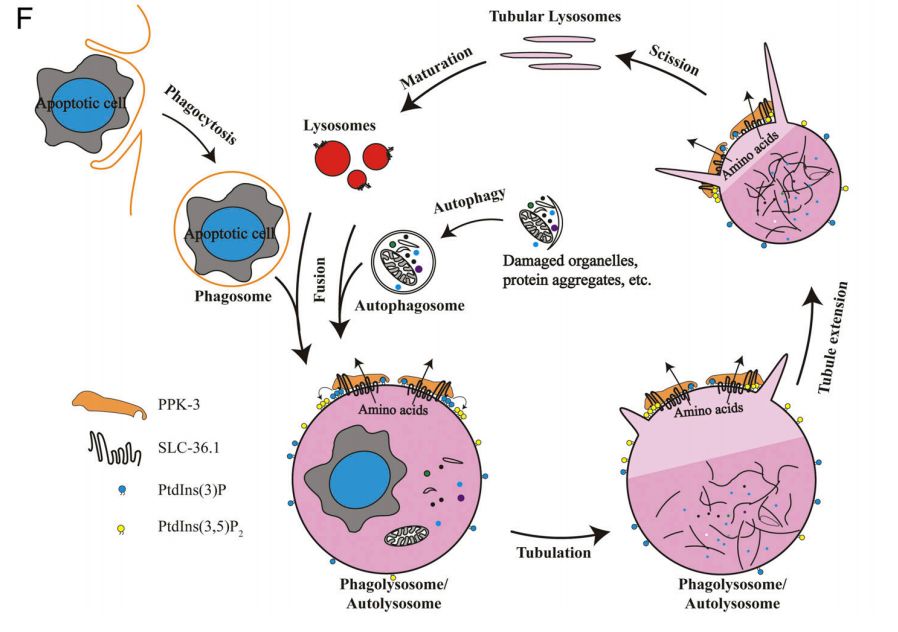
SLC-36.1-PPK-3轴在巨噬细胞和重组溶酶体中作用机制
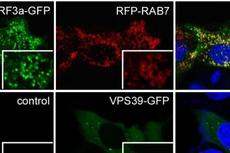
在此,研究人员发现氨基酸转运体SLC-36.1是溶酶体在线虫胚胎清除过程中进行溶酶体重组所必需的。SLC-36.1的丢失导致由含身体的吞噬体产生的吞噬体空泡的形成。在无SLC-36.1的情况下,吞噬体的成熟不受影响,但溶酶体组分的提取受到抑制。此外,PtdIns3P5-激酶PIKfyve的线虫同系物PPK-3的缺失也会导致吞噬溶酶体重组缺陷的巨噬细胞空泡的积累。SLC-36.1和PPK-3在同一遗传途径中发挥作用,它们直接相互作用。此外,SLC-36.1和PPK-3的缺失还会导致成年动物自噬溶酶体重组的严重缺陷。因此,该发现提示PPK-3-SLC-36.1轴在吞噬细胞和自噬溶酶体的形成中起着中心作用。
原文链接:
http://jcb.rupress.org/content/early/2019/06/21/jcb.201901074
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247502464&idx=7&sn=c919305fd196b38d295e27e14078a773&chksm=fce6b95fcb913049d92af2c5330b7c4e1e46d5e58e04fb6060a0467c5924a3cdaf1d1ec929de&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
上海有机所等发现延缓受损神经退化新机制

研究发现溶酶体膜蛋白减轻心肌缺血/再灌注损伤的作用和自噬调控新机制
北理工课题组揭示溶酶体自噬与生物发生的分子机制

Cell | 中科院生物物理所张宏组再一次突破,在自噬领域取得重大进展
神经元释放的IL-33介导小胶质细胞吞噬细胞外基质促进突触重塑

Sci.Adv:自噬激活协同自噬通量阻断抑制肿瘤生长和转移

化学所线粒体自噬过程探针和干预自噬过程策略研究获进展
自噬SNARE蛋白Syntaxin17介导自噬体-溶酶体融合的分子机制

云南大学杨崇林团队揭示神经元中自噬-溶酶体降解调控新机制
【科技前沿】张宏团队揭示SARS-CoV-2抑制自噬溶酶体形成的机制