科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-16
来源:BioArt
CpG DNA甲基化早在70年代就被提出是一种用来控制基因表达的DNA化学修饰,而我们对DNA甲基化在基因组不同区域的具体功能,在疾病、发育过程中所扮演的具体角色,以及控制基因表达的详细机理,直到今天并没有全面详细的认知。
脊髓动物CpG在基因组分布并不均匀,有些集中在一起称为CpG Island(CpG岛),这些CpG岛大多与启动子转录起始位点相重叠。CpG岛大多保持非甲基化状态,而其一旦发生甲基化,经常会导致转录沉默,早期大部分的研究集中在DNA甲基化对启动子CpG岛转录抑制的作用上。然而,大部分启动子尽管保持非甲基化状态,但也可以由其他的表观遗传机制来抑制,比如组蛋白修饰和染色质重塑等。因此在细胞分化、机体发育过程中, 启动子CpG岛的DNA甲基化的调控并不是最动态的。
近年来,全基因组甲基化测序 (WGBS) 数据表明,非编码区域尤其是远端调控元件,比如增强子的甲基化变化与细胞类型变化更相关,而且其调控也更动态 。这些在不同细胞类型中甲基化的区域被称为组织特异性差异甲基化区域 (tissue-specific differentially methylated regions,T-DMR)。有趣的是,在小鼠胚胎干细胞, 这一经常用来研究甲基化调控和机理的细胞类型中,很多活跃增强子的甲基化虽然水平很低,但是并不为零。而这些增强子中,很多是决定细胞命运和身份决定的超级增强子(super-enhancer),这个观察与DNA甲基化在启动子抑制转录的传统观点并不吻合,引起很多兴趣。
2019年8月15日,美国Whitehead研究所Rudolf Jaenisch联合其他课题组(第一作者为宋岳林)在Molecular Cell上发表文章Dynamic Enhancer DNA Methylation as Basis for Transcriptional and Cellular Heterogeneity of ESCs。

随着单细胞甲基化测序(single cell whole genome bisulfite sequencing, scWGBS, and single cell reduced-representative bisulfite sequencing, scRRBS)技术的进步,人们发现看似相同的mESC细胞,基因组的甲基化其实有很大的异质性。于是研究人员提出一个假设,mESC的多能性超级增强子的甲基化在细胞和细胞间是有异质性的,并且这种异质性对于基因转录和细胞状态有着功能性作用。
研究人员选择了Sox2和Mir290-295的超级增强子作为研究对象,以证上述假设。这两个基因的超级增强子对于保持多能性有重要作用,而且其T-DMR在测序数据中显示低水平甲基化。在Castaneous x 129 F1的mESC中(两套基因组之前含大量SNP, 便于区分不同allele),研究人员将两个不同颜色的甲基化报告子 (genomic methylation reporter,RGM) 通过CRISPR/Cas9 敲进Sox2或者Mir290-295的超级增强子T-DMR (RGM-tdTomato在129 allele上,RGM-eGFP在Castenous, CAST allele上),报告子的荧光可以实时反映在单细胞单染色体水平Sox2或者Mir290-295 超子增强子位点的甲基化变化 (图1)。
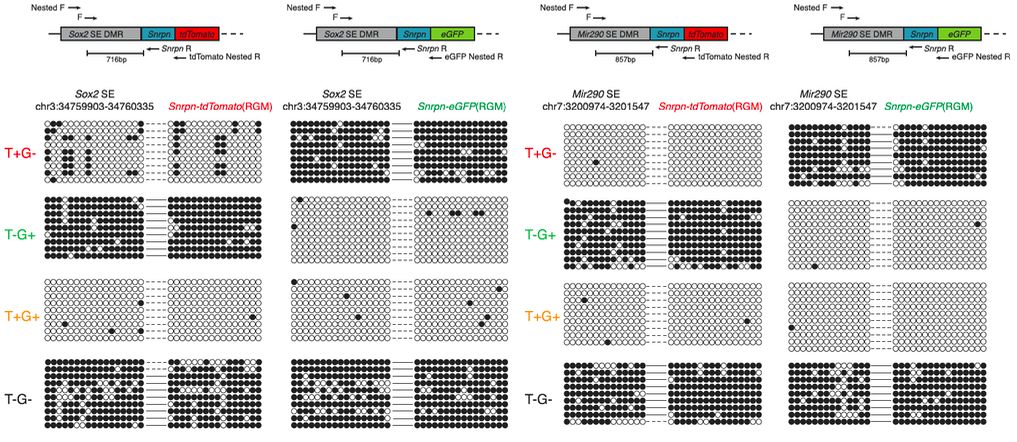
图1:甲基化报告子真实反映内源超级增强子T-DMR的等位基因甲基化水平
出乎意料的是,细胞间的Sox2, Mir290-295 超级增强子的甲基化不但是异质性的,而且还是十分动态的。研究人员利用流式细胞分选 (FACS)纯化出等位基因特异甲基化的细胞,在培养过程中这些细胞会重组之前的表观异质性细胞群 。利用这些胚胎干细胞的动态变化和可纯化性,研究人员通过基因敲除实验发现甲基化的动态变化反映了三个甲基转移酶(DNMTs)的活性动态平衡,揭示去甲基化的过程是被动的。同时动态的甲基化也导致了动态的H3K27ac在增强子和启动子的同步变化。
另外,研究人员还发现中介因子复合体的MED1亚基只在非甲基化的等位基因上聚集,预示了动态的超级增强子甲基化变化在mESC中动态地调节增强子和启动子之间的交流。研究人员利用SNP证实了同一个等位基因上的超级增强子甲基化无论距离多远,都是顺式调节等位基因下游的启动子转录。利用CRISPR/Cas9,研究人员进行了等位基因特异的转录因子结合位点敲除实验,发现没有转录因子结合的超级增强子更容易被甲基化同时也更抵抗被动去甲基化,从而影响整个甲基化动态平衡 (图2)。
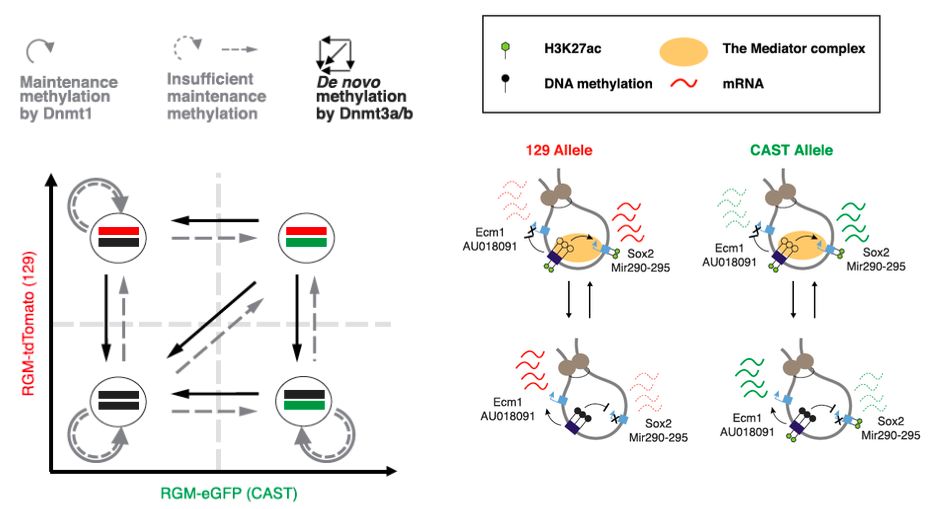
图2:三个甲基转移酶调控超级增强子的甲基化水平,从而动态地调控转录和其他表观遗传修饰
研究人员还发现,Mir290的不同等位基因超级增强子甲基化不会造成细胞生长或者表观遗传的不同,而Sox2如果两个等位基因超级增强子都被甲基化,会导致细胞生长缓慢,全基因组H3K27ac变化,但却还可以保留多能干性分化成三个胚层。
最后,研究人员用这些干细胞构建了有两个等位基因RGM颜色的SOX2-SE-TG和MIR290-SE-TG转基因小鼠,通过分析这些小鼠的早期胚胎,发现囊胚的内细胞团中Sox2, Mir290 超级增强子的甲基化也是异质性和动态变化的。而且由于Sox2和MiR290的表达位置不同,在MIR290-SE-TG小鼠中滋养层的Mir290 超级增强子甲基化也是异质性的 (图3)。

图3:小鼠胚泡显示Sox2和Mir290 super-enhancer的DNA甲基化异质性
至于不同等位基因超级增强子甲基化状态的细胞在体内将来会不会有分化成不同组织的偏好还是个谜。该研究系统第一次实时在单细胞和单染色体水平在体外和体内同时地证明了增强子甲基化的动态调控,而这种动态调控是导致细胞间甲基化水平不同的基础,并且会功能性地导致转录的异质性。该研究的方法学可以被利用到其他系统表观遗传异质性研究中,比如癌细胞,很多癌细胞显示不正常的甲基化水平,而每个细胞的甲基化在不同位点、不同疾病阶段的失控又是十分不同的。利用该研究,可以更细化地区分每个细胞在不同位点和不同时间点的甲基化调控,并且能得出是哪一个下游基因由于甲基化失控导致转录失控,从而更好地理解发育、疾病、衰老的表观遗传调控进程。
原文链接:
https://doi.org/10.1016/j.molcel.2019.06.045
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473998&idx=2&sn=89250b5faabfb8bc78001f9d308fdce5&chksm=84e2193ab395902c81fb491d076d5d1c8dfe50ef5773e19478090dd092bef4f15a8566d2c268&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Molecular Plant 出版“植物激素”专辑

全面分析拟南芥、玉米和高粱核心启动子,助力设计新启动子和作物改良

中国科学家首揭灵长类动物发育和寿命调控的关键通路
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知
增强子选择启动子的新模型
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结

Cell :首个泛癌可变启动子基因表达调控图谱发布
MBE | 环境适应性性状的遗传异质性

杂合的等位基因,诱导小麦单倍体效率更高

Nature Plants :刘磊博士等利用基因编辑技术创制玉米高产等位基因