科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-21
来源:BioArt
蛋白的异常聚集与神经退行性疾病有着密切的关联,比如渐冻症(ALS),额颞叶痴呆症(FTD)和帕金森症(PD)【1】。在部分ALS-FTD病人中发现了TDP-43和FUS蛋白在脑细胞中的沉积。TDP-43和FUS 的类朊蛋白区域可以结合RNA,从而让这些蛋白可以在细胞质和细胞核间自由穿梭【2】。而蛋白沉积导致这些蛋白无法返回细胞核中从而产生毒性。在PD病人中,α-synuclein(α-syn)蛋白则可能形成有毒的可溶多聚体或者淀粉样聚集,这种有毒的蛋白会聚集在Lewy body 和神经突从而导致疾病【3】。由于编码α-syn, FUS,和TDP-43这些蛋白的基因对细胞来说是必不可少的,所以靠减少这些蛋白表达的治疗方案并不可取。比方说,去除黑神经元中的α-syn就有可能导致神经退行【4】。另一方面,虽然这些有毒的蛋白形态十分顽固,但是如果能够溶解这些蛋白沉淀,恢复蛋白活性,那么我们就有可能更好地治疗ALS, FTD 和PD【5-7】。
无独有偶,酵母菌恰恰拥有这种去除顽固朊蛋白能力,使其在压力(比如加热)解除后迅速恢复活性。已研究表明,热休克蛋白Hsp104是其中最重要的蛋白酶,而这种蛋白在哺乳动物中并没有找到共价存在。
2019年8月20日,James Shorter及其团队(共同一作为Amber Tariq,林佳蓓,Meredith Jackrel博士)在Cell Reports杂志上发表文章Mining Disaggregase Sequence Space to Safely Counter TDP-43, FUS, and a-Synuclein Proteotoxicity,试图改进酵母Hsp104蛋白酶使其为人类所用,以治疗神经退行性疾病。

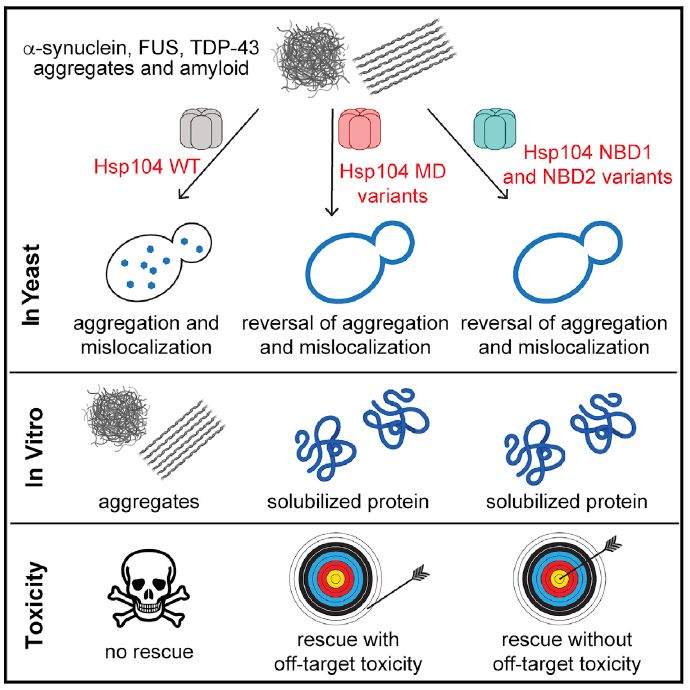
Hsp104是一个六聚蛋白体,有N-端区域,两个核苷酸结合区域(NBD),一个中间区域(MD),和一个C-端区域构成。很多的超活性Hsp104蛋白都是通过改变中间区域的某个氨基酸而实现。某些Hsp104变异蛋白在能够对抗顽固朊蛋白的同时,自身也会产生一定的细胞毒性,这便增加了运用这种方式治疗人类神经退行疾病的危险性。
针对这个问题,James Shorter团队通过筛选核苷酸结合区域的变异点,利用酵母作为模型系统(哺乳细胞和酵母细胞对α-syn,FUS,和TDP-43沉淀造成的细胞毒性有很高的保守性),发现了一系列Hsp104核苷酸结合区变异点可以对抗退行疾病蛋白沉淀造成的毒性,并且自身不会产生任何脱靶效应从而导致细胞毒性。这些超活性蛋白变异点大多在NBD1区域被发现,包括氨基酸位点I187,L355,Q347,I230,E360,E190,E360。而在NBD2区域,只有一个位点可以增强Hsp104蛋白活性,从而缓解α-syn,FUS,和TDP-43沉淀造成的细胞毒性。而NBD1在NBD2的对应位点并无法相应的增强Hsp104蛋白活性,从而说明NBD1和NBD2从属于不同的进化分支。
总之,本文发现的NBD1和NBD2位点变异活性蛋白,无脱靶副作用,从而为进一步在哺乳动物系统中应用这些活性变异蛋白治疗神经退行疾病提供了基础,我们可以通过基因疗法,mRNA导入,或者蛋白植入疗法来达到这一目的。比如,可以用AAVs病毒在且仅在退行的神经细胞中引入Hsp104 活性蛋白。使用此方法可以有效地减少免疫对抗且在不影响宿主基因序列的情况下有效的在中枢神经系统进行蛋白表达。并且美国药监局已经认可了使用AAV来治疗congenital blindness和spinal muscular atrophy,无疑让此种治疗方案变得更加可行。另外,我们还可以通过AAV引入单一剂量的Hsp104活性基因,终生携带,而蛋白的表达可以通过口服小分子来开启或者关闭,从而减少免疫对抗和脱靶毒性等副作用。
原文链接:
https://doi.org/10.1016/j.celrep.2019.07.069
参考文献
1. Chuang, E., Hori, A.M., Hesketh, C.D.& Shorter, J. J Cell Sci 131(2018).
2. Harrison,A.F. & Shorter, J. Biochem J 474, 1417 (2017).
3. Abeliovich,A. & Gitler, A.D. Nature 539, 207 (2016).
4. Collier,T.J., Redmond, D.E., Jr., Steece-Collier, K., Lipton, J.W. & Manfredsson,F.P. Front Neurosci 10, 12 (2016).
5. Guo,L. & Shorter, J. Cold Spring HarbPerspect Med (2016).
6. Guo,L., et al. Cell 173, 677 (2018).
7. Jackrel,M.E. & Shorter, J. Dis Model Mech7, 1175 (2014).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474161&idx=6&sn=c8d44ad667202656789151b8b136cf10&chksm=84e21885b395919375d7e8f4796cb6c9d607d50100c4d762aa7c165f94f373729a63b4bb3945&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
神经退行性疾病

基因疗法可预防致命神经退行性疾病

无创神经调控在治疗神经退行性疾病中的进展与挑战
多篇文章解读神经退行性疾病研究进展!
吴瑛研究组发现TDP-43激活线粒体UPR诱导线粒体损伤及神经退行性疾病的新机制

衰老诱发神经退行性疾病分子机理获揭示

Sci Adv:DNMT1突变导致神经退行性疾病分子机制
神经退行性疾病的标记物

利用石墨烯打造神经探针芯片,有望改善神经退行性疾病

老了会不会痴呆,也许和生物钟有关