科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-23
来源:BioArt
原标题:Cell:陈斯迪组首次在CD8 T 细胞中实现体内全基因组CRISPR 筛选并发现全新的免疫治疗新靶点
癌症免疫治疗是一种利用病人自身免疫系统来杀伤癌细胞的新型革命性疗法。近年来,免疫疗法以其对某些晚期转移性恶性癌症的优越的长期疗效,给此前近乎无药可用的晚期癌症病人带来曙光。靶向T淋巴细胞检查点的免疫疗法在过去几年已在近二十种癌症中获批,在几种癌症比如转移性肺癌等成为一线标准疗法。为此,免疫检查点疗法的鼻祖Allison和Honjo获得2018年诺贝尔生理医学奖以表彰他们在该领域的开创性贡献。
尽管如此,现行的免疫检查点疗法在大部分的病人中没有明显的疗效。因此,如何提高免疫疗法的疗效和拓展适应病人群体是目前肿瘤医学研究的热点。CD8 阳性T细胞在免疫治疗中具有核心作用【1】。近年来,研究发现T细胞表面的免疫刺激性和免疫抑制性分子在CD8+ T细胞的活化和杀伤中具有重要的作用【2】。特别是是靶向T细胞表面免疫抑制性分子(如PD1和CTLA4)的免疫检查点疗法在临床癌症治疗中取得了巨大的成功【3-5】。然而在临床上对PD-1免疫检查点疗法有反应的患者在大部分癌症种类的病人群体一般不超过30%。因此,寻找更多且高效的免疫治疗新靶点一直是该领域的难题。此外,过继性T细胞治疗(ACT)技术包括嵌合抗原受体T细胞(CAR-T)和T细胞受体(TCR)嵌合型T细胞(TCR-T),通过基因改造的手段提高T细胞对特异性癌症细胞抗原的识别和杀伤,目前在血液系统肿瘤中取得了良好的治疗效果【6,7】。然而过继性T细胞治疗在抗肿瘤治疗中,尤其是在实体瘤治疗中仍有很多困难需要克服。其中CD8+ T细胞的肿瘤浸润、增强特异性杀伤能力和逆转T细胞衰竭成为目前研究的的重中之重。CRISPR技术提供了一种简单、高效,且快速的手段对基因组进行特异性敲除【8,9】。CRISPR技术与高通量测序技术的结合,可以高通量且准确的筛选出与特定表型相关的基因【10,11】。
2019年8月22日,耶鲁大学陈斯迪(Sidi Chen)课题组在Cell杂志上以长文形式发表文Systematic Immunotherapy Target Discovery Using Genome-Scale In Vivo CRISPR Screens in CD8 T Cells,利用过继性T细胞治疗(ACT)小鼠模型和体外CD8+ T细胞杀伤实验,在全基因组水平上对CD8+ T细胞中与肿瘤免疫治疗相关的基因进行筛选,成功找出了一批T细胞中与肿瘤浸润,T细胞毒性杀伤相关的关键基因。

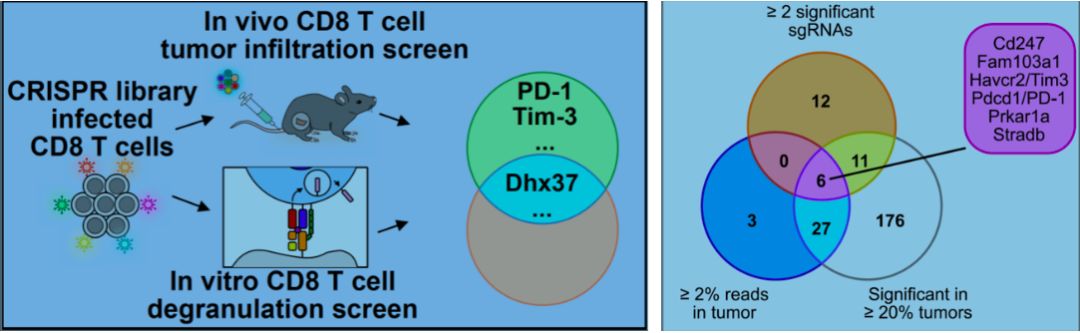
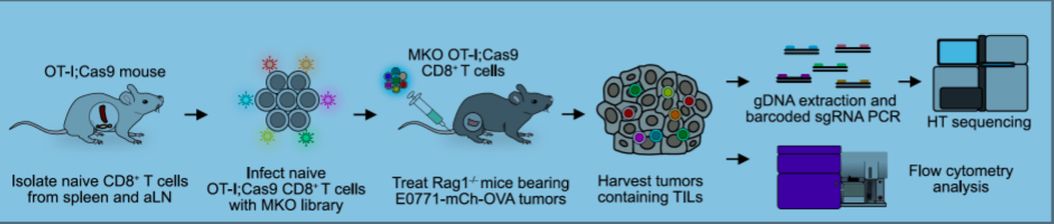
研究人员首先将全基因组CRISPR sgRNAs 用慢病毒包裹,然后感染小鼠CD8+ T 细胞,再利用三阴乳腺癌的过继性CD8+T细胞治疗模型,筛选出CD8+ T 细胞中与其肿瘤浸润相关的基因。研究人员利用几种不同的富集分析方法,发现6个高度富集的基因(Cd247, Fam103a1, Hacvr2/Tim-3, Pdcd1, Prkar1a, Stradb),这些基因的敲除能显著增强CD8+ T细胞对肿瘤的浸润。其中Pdcd1和Tim-3是已经广为人知的免疫治疗靶点,侧面验证了用此方法筛选CD8+T细胞肿瘤浸润的可靠性。为了进一步筛选CD8+ T细胞中能增强肿瘤杀伤的基因, 研究人员通过T细胞和肿瘤细胞的体外共培养,通过流式分选CD107a强阳性细胞(top 5%, 利用CD107a 作为T细胞脱粒杀伤功能的表面标志)来筛选CD8+ T细胞中与肿瘤杀伤相关的基因。他们进一步分析在体内肿瘤浸润和体外T细胞毒实验中都得到富集的3个靶标(Dhx37, Lyn和Odc1)。在后续的研究中作者聚焦在了一个全新免疫疗法相关基因Dhx37的功能验证和机制研究。体内肿瘤浸润和杀伤实验发现,敲除Dhx37的CD8+ T细胞在体内具有更强的杀伤肿瘤的能力,延缓了肿瘤的生长速度。作者通过流式分析Dhx37对T细胞功能的影响,发现Dhx37敲除的CD8+ T细胞能表达更高水平的与T细胞激活和耗竭相关的分子标志物,如CD69, CD27, Pd-1, Lag3和Tim-3,而且它们在抗原刺激后有更强的分泌Ifnγ和GzmB的能力。
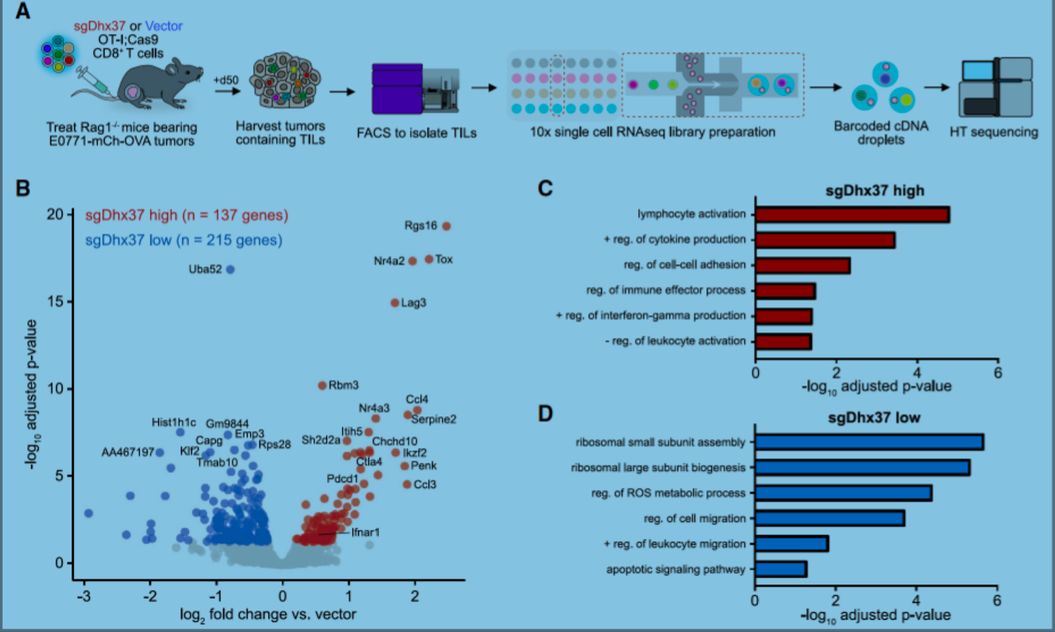
Dhx37是一种高度保守的DEAH box类RNA解旋酶,据报道,它通过释放U3 snoRNA参与小核糖体亚基的生物合成【12】。目前尚无Dhx37与T细胞功能相关的报道。作者对肿瘤浸润CD8+ T细胞进行单细胞RNA测序(scRNA-seq)与体外T细胞DHX37敲除转录表达组分析,发现免疫功能相关信号通路,包括淋巴细胞活化、细胞因子的正调节信号、免疫效应过程调节以及干扰素-γ的正调节信号,在Dhx37敲除的CD8+ T细胞中上调。作者对Dhx37敲除后上调基因启动子中的调节序列进行分析,发现最强的序列基序对应NF-kB调节基序,暗示Dhx37至少部分地通过调节NF-kB起作用。随后,免疫沉淀(IP)实验证实DHX37,PDCD11, 和NF-kB的p65组分在人CD8+ T细胞中存在相互作用。
最后,作者通过分析癌症病人中肿瘤浸润CD8+ T细胞的scRNA-seq数据,发现DHX37在耗竭T细胞(exhausted T cells)中有更高的表达。作者使用“肿瘤免疫功能障碍与排除,TIDE”分析肿瘤浸润T细胞中DHX37表达水平与乳腺癌患者的预后关系,发现虽然高水平的肿瘤T细胞浸润与病人预后良好相关,但在Luminal A型乳腺癌和三阴乳腺癌(TNBC)中,高表达的DHX37会损害或消除T细胞浸润的益处。
综上,肿瘤免疫浸润和T细胞有效杀伤是目前免疫治疗成功的关键,本文提供了通过结合体内过继性T细胞治疗的肿瘤模型和体外共培养实验,来筛选T细胞中与肿瘤免疫治疗相关基因的方法。文中揭示DHX37在耗竭T细胞中有更高的表达,机理实验暗示DHX37通过与NF-kB核心成分相互作用来调节T细胞功能,并与癌症患者的T细胞功能障碍相关的临床结果相关。敲除Dhx37可以增强T细胞的免疫杀伤能力,为临床上的肿瘤免疫治疗提供了参考。这项高通量体内T细胞筛选技术也开创了寻找潜在免疫疗法新靶点的快速通道,为发展未来更安全有效的免疫疗法铺开新途径。
该研究通讯作者为耶鲁大学Sidi Chen(陈斯迪)教授。共同第一作者为本实验室MD. PhD学生曾家宝(Matthew Dong),王广川博士、周子崴(Ryan Chow)和叶露鹏博士。
原文链接:
https://doi.org/10.1016/j.cell.2019.07.044
制版人:珂
参考文献
1.D. C. Tscharke, N. P. Croft, P. C. Doherty, N. L. La Gruta, Sizing up the key determinants of the CD8(+) T cell response. Nature reviews. Immunology 15, 705-716 (2015).
2.L. Chen, D. B. Flies, Molecular mechanisms of T cell co-stimulation and co-inhibition. Nature reviews. Immunology 13, 227-242 (2013).
3.F. S. Hodi et al., Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 363, 711-723 (2010).
4.S. L. Topalian et al., Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 366, 2443-2454 (2012).
5.P. C. Tumeh et al., PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 515, 568-571 (2014).
6.C. H. June, R. S. O'Connor, O. U. Kawalekar, S. Ghassemi, M. C. Milone, CAR T cell immunotherapy for human cancer. Science 359, 1361-1365 (2018).
7.S. A. Rosenberg, N. P. Restifo, Adoptive cell transfer as personalized immunotherapy for human cancer. Science 348, 62-68 (2015).
8.L. Cong et al., Multiplex genome engineering using CRISPR/Cas systems. Science 339, 819-823 (2013).
9.M. Jinek et al., A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 337, 816-821 (2012).
10.O. Shalem et al., Genome-scale CRISPR-Cas9 knockout screening in human cells. Science 343, 84-87 (2014).
11.S. Chen et al., Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell 160, 1246-1260 (2015).
12.A. Roychowdhury et al., The DEAH-box RNA helicase Dhr1 contains a remarkable carboxyl terminal domain essential for small ribosomal subunit biogenesis. Nucleic Acids Res, (2019).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474300&idx=2&sn=d9028df9fc5f15641e8d81ea2c69a4b0&chksm=84e21808b395911ef19ea27c256718d21624481e39fea560f06372c5b0895ebea4e7f8b9a5c5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn