科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-25
来源:研之成理

▲第一作者:杨悦;通讯作者:张晓兵教授
通讯单位:湖南大学
论文DOI:10.1002/anie.201906758
近日,在湖南大学张晓兵教授带领下,其团队成员宋国胜教授和陈美老师协助指导杨悦博士发展了一种改善肿瘤乏氧的新策略,并显著增强肿瘤放疗。
全文速览
缺氧作为实体瘤的一个特征,对癌症治疗产生了不利的影响。我们采用二维 Pd@Au 双金属核-壳纳米结构用于内源性 H2O2 的长期催化和持续的 O2 产生;同时,NIR-II 激光照射引发的表面等离子体共振效应会增强 Pd@Au 的催化活性增加 O2 产生,实现克服肿瘤缺氧诱导的放射治疗耐受性的目的。
背景介绍
A. 肿瘤放射治疗
辐照放射治疗可以直接引起细胞 DNA 损伤,在该过程中也会产生大量活性氧诱导细胞死亡,实现肿瘤区域精确电离辐射。目前,放射治疗已经与手术切除,化学治疗和光学治疗一起发展成为有光明前景的肿瘤治疗策略。
然而,放射治疗仍然存在一些缺点。高强度辐射能量(X 射线或 γ 射线)若被正常软组织吸收,会对邻近组织造成严重损伤。为了克服这些障碍,许多可以吸收 X 射线的贵金属纳米粒子被开发为放射增敏的高 -Z 材料,通过在肿瘤内沉积辐照能量来达到增强放射治疗效果。
B. 肿瘤微环境特征
肿瘤微环境与正常组织不同,具有缺氧,偏酸性 pH 和 H2O2 水平升高的特点。具体而言,肿瘤的氧含量不足在癌症治疗中发挥抑制作用。在放疗过程中,O2 辅助电离辐射诱导 DNA 损伤,从而促使细胞凋亡。
最近,开发了多种纳米材料,比如全氟化碳、MnO2、金属纳米颗粒,和纳米技术直接将 O2 运载到肿瘤部位或在肿瘤原位生成 O2,致力于缓解肿瘤缺氧负影响或提高O2水平。然而,这些策略仍然受到三个方面的制约:
(i)由于纳米材料的消耗无法持续产生O2;
(ii)缺乏对缓解肿瘤缺氧的精准控制;
(iii)纳米结构的复杂性和各组分单一功能。
因此,研究出新的策略克服上述问题,从而缓解缺氧诱导的癌症治疗耐受性是很有必要的。
研究出发点
由于 Pd@Au 可以催化肿瘤内源性 H2O2 促进 O2 的产生;再考虑到 Pd@Au 具有很强的红外光谱吸收,出于表面等离子体共振效应可以产生热电子并增强化学过程能量,从而促使 NIR-II 激光增强 H2O2 催化 O2 产生。此外,由于 Au 和 Pd 都是高 -Z 元素,可以实现多模态精准成像和光热/放射联合治疗。
图文解析
Pd@Au 用 TEM,STEM,元素面扫描图,DLS 等做了表征,文章里有介绍,这里不多做赘述(Figure. 1)。
研究 Pd@Au 的催化活性,通过溶解氧仪测量溶液的 O2 浓度,证明了 Pd@Au 不仅可以催化 H2O2 产生 O2,并且可以实现持续催化。同时,也验证了 Pd@Au 在生理环境中以及在苛刻酸碱性、高温下的优良的催化活性(Figure. 2)。
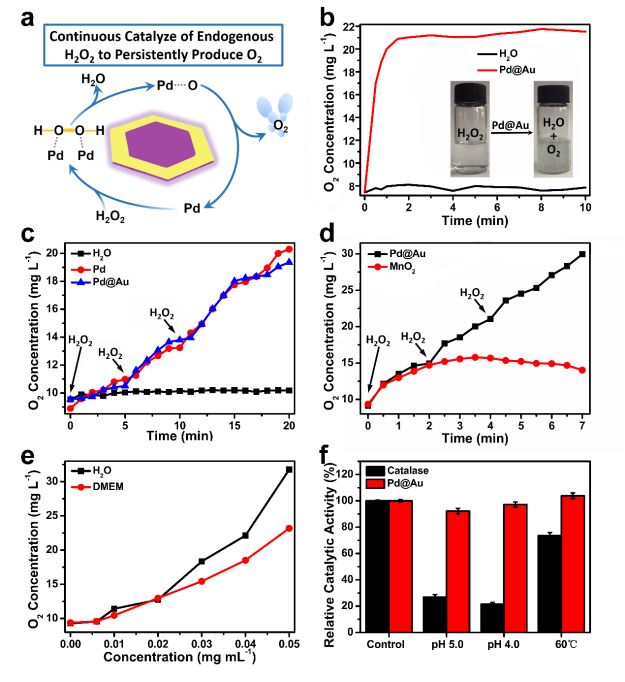
▲Figure 2. a) Schematic illustration of Pd@Au for catalysis of H2O2 and continuous production of O2. b) The O2 concentration of H2O2 solution after addition with Pd@Au or H2O. c) The O2 concentration of solution treated with Pd or Pd@Au, upon repeating addition of H2O2. d) The O2 concentration of solution treated with Pd@Au or MnO2, upon repeating addition of H2O2. e) The O2 concentration of H2O and DMEM (containing 20%). f) Relative catalytic activity of Pd@Au and catalase per-treated with low pH and high temperature.
考虑到 Pd@Au 在近红外区域的高吸收,模拟计算了 Pd@Au 的时域有限差分。同时,我们证明了表面等离子体共振能增强了 O2 的产生,在 NIR-II 激光照射下,Pd@Au 可以增强催化 H2O2 产生 O2 而不产生明显的升温(Figure. 3)。然后,我们研究了 Pd@Au 在体内缓解肿瘤缺氧的能力,发现 Pd@Au 可以在肿瘤微环境中持续分解内源性 H2O2 来持续产生 O2,也可以在 NIR-II 激光照射下快速产生 O2(Figure. 4)。
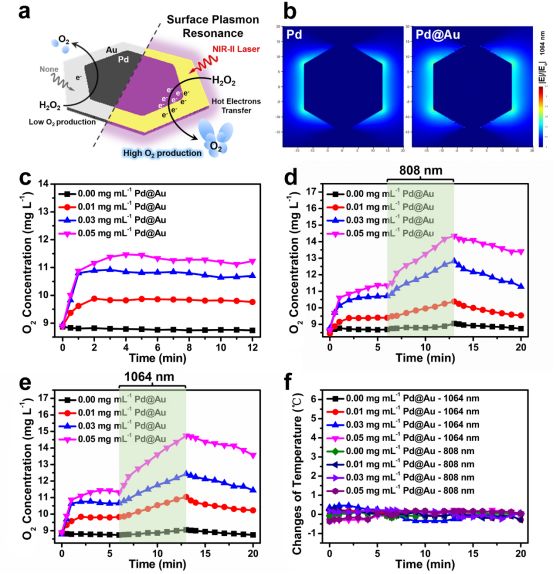
▲Figure 3. a) Schematic illustration of Pd@Au for rapid increase of O2 concentration under NIR-I or NIR-II laser irradiation via surface plasmon resonance effect. b) Comparison of electric field enhancement (|E|/|Eo|) contours of bare Pd and Pd@Au at 1064 nm excitation. c) The O2 concentration of H2O2 incubated with different concentration of Pd@Au without irradiation by 808 or 1064 nm laser. d) and e) The O2 concentration of H2O2 incubated with different concentration of Pd@Au and under irradiation by 808 or 1064 nm laser from 6th min to 13th min. f) The monitored temperature changes of the solution in (d and e).
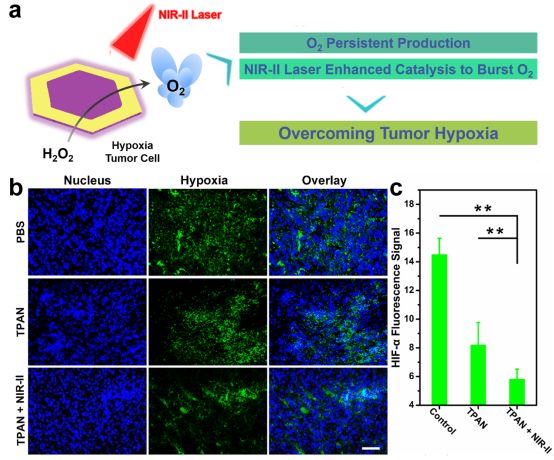
▲Figure 4. a) Schematic illustration of TPAN to relieve tumor hypoxia in vivo via persistent supplement of O2 and laser triggering rapid O2 production manner. b) HIF-1α staining of 4T1 tumor treated with PBS, TPAN only and TPAN + NIR-II laser, respectively (Blue color indicated cell nucleus; green color indicated HIF-1α); scale bar, 50 μm. c) Quantification of tumor HIF-α fluorescence signal of different groups revealed in (b). P values: **P < 0.01, ANOVA.
最后,我们证明了Pd@Au具有X射线、光声和光热三模成像能力和光热/放射联合治疗效果,文章里有详细介绍,这里不多做赘述 (Figure 5和6)。
总结与展望
我们开发了一种缓解肿瘤缺氧的新策略,通过等离子体增强催化克服缺氧诱导的放射治疗耐药性。具体来说,使用二维 Pd@Au 核-壳纳米结构用于实体瘤中催化过量 H2O2以连续产生 O2。值得注意的是,O2 的产生可以通过 NIR-II 激光照射触发的表面等离子体共振效应来增强,使得 Pd@Au 具有克服肿瘤缺氧和增强放疗增敏效果的能力。我们已经证明,我们提出的纳米平台可以在体内实现令人满意的放射和光热联合治疗效果。
文章链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201906758
来源:rationalscience 研之成理
原文链接:http://mp.weixin.qq.com/s?__biz=MzIwMzE5MzQ1NQ==&mid=2649331550&idx=3&sn=80c239becff41c7efd88b7f79250fcd0&chksm=8ece1a5eb9b9934858de3e2223c6131dca550322c540ab81faf64fa86507110e949cef86bf0f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

新型纳米诊疗剂发挥光热/放疗协同肿瘤治疗作用
中国抗癌协会肿瘤护理专业委员会在津成立



连续增加单个金属原子相同配体保护的Au21,Au22,Au22Cd1,Au24系

三维插植近距离放疗精准定位杀灭肿瘤

“一站式”方案,开启肿瘤放疗2.0时代

二甲双胍在恶性肿瘤放疗中的应用

【每日科技速递】国家发展改革委:大力推动营商环境改善

“青稞”有约 | 周民:巧用微藻输送氧气,提升肿瘤放疗效果

从全程到精准:肿瘤放疗营养的规范化成果分享

Nano Today:新型催化放疗策略用于肿瘤高效治疗