科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-26
来源:BioArt
人体免疫系统的重要特性之一就是能够在不损伤健康细胞或组织的前提下,抵抗病原菌的入侵。其中趋化性运输(chemotactic trafficking)—由20种GPCRs和40多种趋化因子构成—介导免疫细胞在正确的时间到达正确的地点。炎症性趋化因子及其受体被炎性刺激上调,而稳态性趋化因子则构成性表达,持续性导航细胞到达特定的器官,形成“细胞的高速公路”。稳态性趋化因子CCL9、CCL21结合CCR7,介导B、T、DC细胞到达全身的淋巴结,CCR7在平衡免疫反应和耐受间起重要作用【1】。
CCR7及其配体在类风湿性关节炎模型中有重要作用【2】。而且,有些病原菌能够利用CCR7介导DC细胞迁移到淋巴结的特性【3】,从而传播到其他器官。CCR7和多种癌症具有相关性,癌症细胞借助趋化性运输(chemotactic trafficking)进行淋巴结转移。如CCR7在结直肠癌中表达,与淋巴血管入侵和生存率下降有关【4】。所以,沉默CCR7的小分子配体极有可能抑制淋巴结转移,从而减少癌症相关的死亡。但是,首先,设计能够靶向CCR7的小分子配体非常困难。其次,其他的趋化因子受体如CXCR1、CXCR2、CCR5、CXCR4也参与肿瘤的转移,可能出现补偿作用。而且,小分子需要进行筛选,以降低治疗的副作用。那么如何设计靶向CCR7的小分子配体,如何优化筛选过程,需要进一步研究。
2019年8月22日,来自瑞士的Roger J.P. Dawson和Jörg Standfuss在Cell杂志上发表文章Structural Basis for Allosteric Ligand Recognition in the Human CC Chemokine Receptor 7,使用结构生物学手段揭示了小分子配体Cmp2105能够结合到人源CCR7的变构结合口袋(allosteric binding pocket)的胞内段,抑制CCR7的活化;TM7-H8 motif是结合的关键位点。同时,鉴定出几种CCR7的拮抗剂,为研究靶向CCR7治疗癌症提供了新的工具。

首先,研究人员将CCR7与蛋白Sialidase NanA进行融合表达促进CCR7结晶,得到分辨率为2.1A°的晶体结构信息。综合比较CCR2、CCR5、CCR9、CXCR4等人源趋化因子受体的晶体结构信息发现,这些受体的变构趋化因子结合口袋的胞外段在序列和结构上的差异要大于其胞内段部分。CCR7属于GPCRs家族,本质上是变构性蛋白,通过调控7次跨膜结构域的胞内、胞外段实现传导信号的功能。那么靶向CCR7的胞内变构结合位点或许是癌症治疗的理想位点,有效抑制趋化因子介导的淋巴系统的癌症转移。
有报道显示,包含有thiadiazole-dioxides结构的小分子化合物能够结合CCR7。研究团队选取了包含thiadiazole-dioxides结构的小分子Cmp2105,检测是否能够结合CCR7。研究显示Cmp2105的存在增强CCR7的热稳定性,同时Cmp2105能够与配体CCL19竞争性结合CCR7,使CCR7稳定在失活的构象。结构学分析显示Cmp2105与CCR7的变构结合口袋的胞内段结合,抑制CCR7的活化。Cmp2105有1个thiadiazole-dioxide核心基团和2个胺连接取代基团。其中取代基团和TM2、TM1上的残基形成相互作用,并在TM3的ERY motif和TM7的NPxxY motif的几个保守残基上形成盐桥,导致受体活化需要胞内段进行更大的构象变化;两个胺基与ASP942.40形成氢键;磺酰基团和TM7、H8间的保守残基相互作用,而且TM7-H8 motif是竞争性配体结合的关键位点,CCR9、CCR2与拮抗剂的结构证实了这一观点。所以,在变构结合口袋中保守的TM7-H8 motif是抑制趋化因子受体的一个非常有前景的靶向位点。
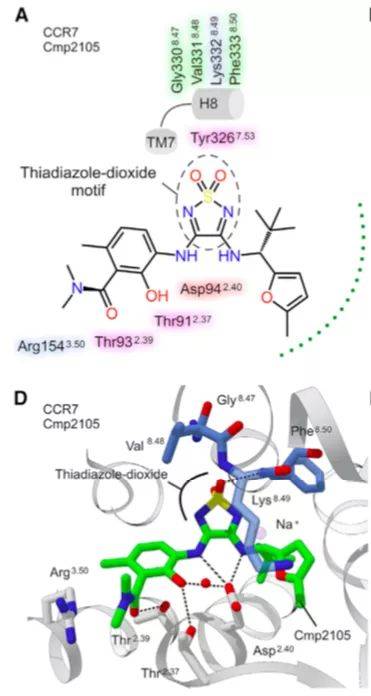
虽然CCR2、CCR9、CCR7都通过TM7-H8motif与拮抗性配体相互结合,但是CCR2、CCR9的拮抗剂对CCR7的热稳定性没有作用;虽然CXCR2的拮抗剂Danirixin和CXCR1/CXCR2的拮抗剂Reparixin都有磺胺基团,但是对CCR7的热稳定性没有作用。那么决定趋化因子受体对配体的选择性的关键因素是什么?研究人员通过3D形状类似度和热稳定性试验对化合物文库进行筛选,结果显示不同的趋化因子受体对化合物的核心motif有选择性,例如CCR7可以和核心motif为thiadiazole-dioxide(Cmp2105)、thiazole-dioxide(CS-1)、cyclobutene-dione(Navarixin)的小分子化合物结合;CXCR1/CXCR2同样可以和核心motif为cyclobutene-dione(Navarixin)结合;CCR9和核心motif为sulfonamide的Vercimon结合。其中Navarixin与Cmp2105除了核心motif不同外,高度相似。Navarixin能够提高CCR7的热稳定性,竞争性抑制CCL19的结合,但效果均弱于Cmp2105,这可能和Navarixin的羰基不能和CCR7形成氢键有关。
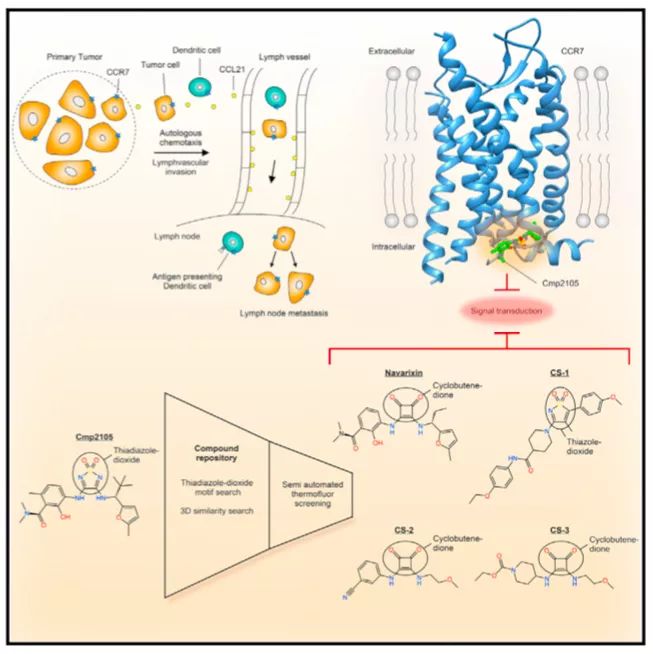
总的来说,此项工作利用蛋白质的晶体结构信息辅助筛选靶向CCR7的小分子化合物,揭示出TM7-H8 motif是药物性靶向趋化因子受体的可能靶点,为研发趋化因子受体的拮抗剂提供了新的思路。
原文链接:
https://doi.org/10.1016/j.cell.2019.07.028
参考文献
1. Förster, R., Davalos-Misslitz, A.C., and Rot, A. (2008). CCR7 and its ligands: balancing immunity and tolerance. Nat. Rev. Immunol. 8, 362–371.
2. Moschovakis, G.L., Bubke, A., Friedrichsen, M., Ristenpart, J., Back, J.W., Falk, C.S., Kremmer, E., and Fo ̈rster, R. (2018). The chemokine receptor CCR7 is a promising target for rheumatoid arthritis therapy. Cell. Mol. Immunol.
3. Pron, B., Boumaila, C., Jaubert, F., Berche, P., Milon, G., Geissmann, F., and Gaillard, J.L. (2001). Dendritic cells are early cellular targets of Listeria mono- cytogenes after intestinal delivery and are involved in bacterial spread in the host. Cell. Microbiol. 3, 331–340.
4. Gu ̈ nther, K., Leier, J., Henning, G., Dimmler, A., Weissbach, R., Hohenberger, W., and Fo ̈ rster, R. (2005). Prediction of lymph node metastasis in colorectal carcinoma by expression of chemokine receptor CCR7. Int. J. Cancer 116, 726–733.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474405&idx=4&sn=d91948d1b4a93b25d1ce445cf8292c69&chksm=84e21f91b39596874ac3c84e2f6893112f69fccf279ce967a7797d4cc52a54f49235cdcab133&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【癌症知多少】我非常担心得淋巴瘤,怎样预防或早期发现这种疾病呢?

Cell:两条腿走路!癌症治疗的新起点

登上Cell封面:一览无余,人类首次看清体内所有癌症转移!
Cell公布令人惊喜的癌症免疫新疗法

Cell:首个激酶组图谱为开发靶向癌症相关激酶的降解剂奠定基础

速度提高300倍!Cell介绍检测癌症转移的新技术

Cell:β-葡聚糖启动免疫系统攻击癌症
中国抗癌协会王瑛秘书长出席河北省肿瘤防治宣传周启动仪式



小心了!Cell揭示缺少这种淋巴细胞可保护癌细胞、抵抗肿瘤治疗!
第十四届海峡两岸肿瘤学术会议在台北成功召开


