科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-17
来源:BioArt
ADP-核糖基化(ADP-ribosylation)修饰是一种常见的蛋白质翻译后修饰,在包括DNA损伤修复,细胞增殖和分化,代谢,应激和免疫反应等的一系列生物学过程中发挥重要功能。在DNA损伤修复过程中,当DNA损伤发生后,ADP-核糖基化酶PARP1及同源物PARP2作为DNA损伤的第一响应者,会最先被损伤的DNA募集到损伤位点以NAD+为原料对组蛋白和其他底物进行单体和多聚核糖基化(PARylation)修饰。研究表明, DNA损伤特异的PARylation修饰多发生在底物的丝氨酸残基上,这一过程需要HPF1(PARylation Factor 1)辅助因子的协助。HPF1可指导PARP1/2 以NAD+为原料对底物蛋白质中KS motif中的S丝氨酸残基进行修饰。DNA损伤诱导的PARylatio对于损伤发生后的染色质解压缩,DNA损伤修复因子的招募是至关重要的。靶向PARP活性的抑制剂在癌症治疗中被广泛研究和应用(详见BioArt报道:Nat Chem Bio | 余永豪组利用靶向蛋白质降解分离PARP1抑制剂的催化抑制和捕获活性机制)。
2020年2月6日,牛津大学Ivan Ahel实验室在Nature发表文章HPF1 completes the PARP active site for DNA damage-induced ADP-ribosylation,报道了HPF1结合到PARP2催化结构域的结构。结合NMR和生化数据,该文章揭示了由来自HPF1和PARP1/2的残基共同形成的全酶活性位点,证明该复合活性中心的组装对于细胞中DNA损伤诱导的 PARylation的发生至关重要, 同时该研究提出了PARP酶活性被调控的分子机制。该项研究提出如下模型:在没有DNA损伤的情况下, PARP的抑制结构域-HD(helical subdomain)处于折叠状态,抑制其与HPF1,NAD+的结合;当PARP结合受损伤的DNA后导致其构象发生变化,HD抑制结构域展开,抑制作用解除,促进HPF1-PARP复合活性中心的形成,活性中心进一步结合组蛋白等底物,以NAD+为原料对底物的丝氨酸残基进行DNA损伤特异的核糖基化修饰。该研究提出了HPF1参与DNA损伤诱导PARP酶活性的分子机制,暗示了HPF1可能可以直接通过影响PARP的抑制和捕获从而影响临床应用PARP抑制剂治疗肿瘤过程中患者对于PARP抑制剂的反应。

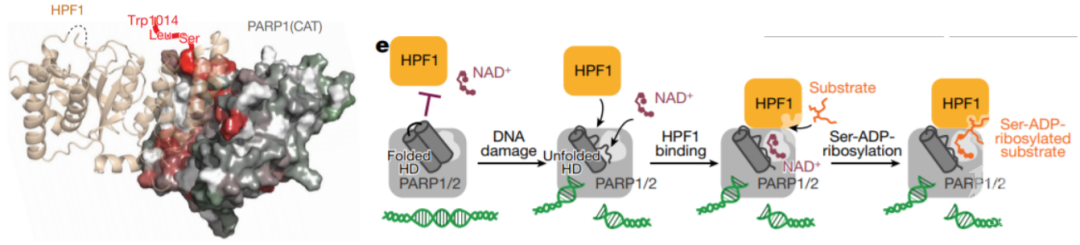
2020年9月16日, St Jude Children’s Research Hospital的Mario Halic团队Nature杂志上发表了文章Bridging of DNA breaks activates PARP2–HPF1 to modify chromatin,在上一篇Nature文章(通讯作者Ivan Ahel也是这篇Nature的参与人)的基础上,进一步提出了DNA损伤如何激活PARP-HPF1催化活性以及其发挥催化功能的工作模型。

为了理解PARP识别并结合受损伤DNA的分子机制,该团队首先组装了PARP2–HPF1与核小体单体复合物,核小体单体用以模拟染色质环境下断裂的DNA。冷冻电镜结构显示,PARP2–HPF1复合物可以桥连两个核小体,使断裂的DNA处于适宜连接的位置。进一步体外实验证明,PARP2–HPF1对DNA末端核小体的桥接可以导致PARP2发生结构变化,通过改变其抑制结构域HD的构象,使HD结构域的抑制作用消失,促进其催化活性的激活。
为了更加清晰理解PARP2–HPF1被激活后催化组蛋白等底物发生PARylation修饰的过程,该研究除了获得PARP2–HPF1的稳定构象之外还捕获了更多动态过程。通过对更多动态过程的解析,该研究提出了PARP在不同构象间循环的工作模型:PARP2–HPF1桥连DNA被激活后,可以在不同构象下交换NAD+,执行其催化功能,释放底物。这一动态过程的循环使得PARP–HPF1复合物在结合并保护DNA末端的同时,实现对多个底物持续不断发挥催化功能。随后,该研究通过体外生化实验以组蛋白H3为底物进一步探究了PARylation修饰发生的动态过程,发现PARP催化的组蛋白H3 PARylation发生非常迅速,并且在其对H3进行修饰的过程中PARP2–HPF1复合物保持和核小体的结合。随着反应时间的增长,PARP2自身PARylation修饰增加逐步最终导致PARP2–HPF1复合物从核小体的解离,终止修饰反应,将桥连的损伤DNA移交给其他修复因子。这一结果为染色质环境下,PARP催化组蛋白等底物PARylation的发生过程提供了动态模型。该研究在上一篇Nature文章的基础上更加详细分析了DNA 损伤发生后,PARP识别受损伤的DNA并与HPF1构成全酶对组蛋白等底物进行修饰,以及修饰完成后通过其自身PARylation而从染色质上解离下来的动态过程。
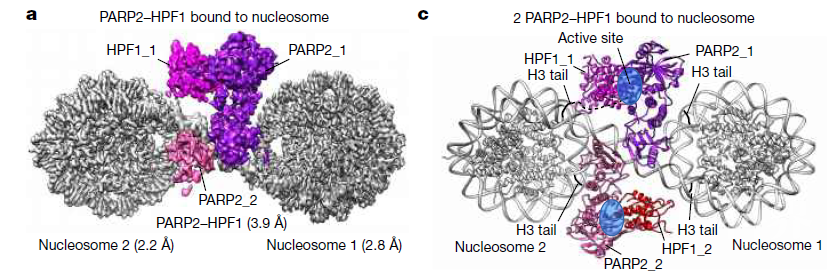
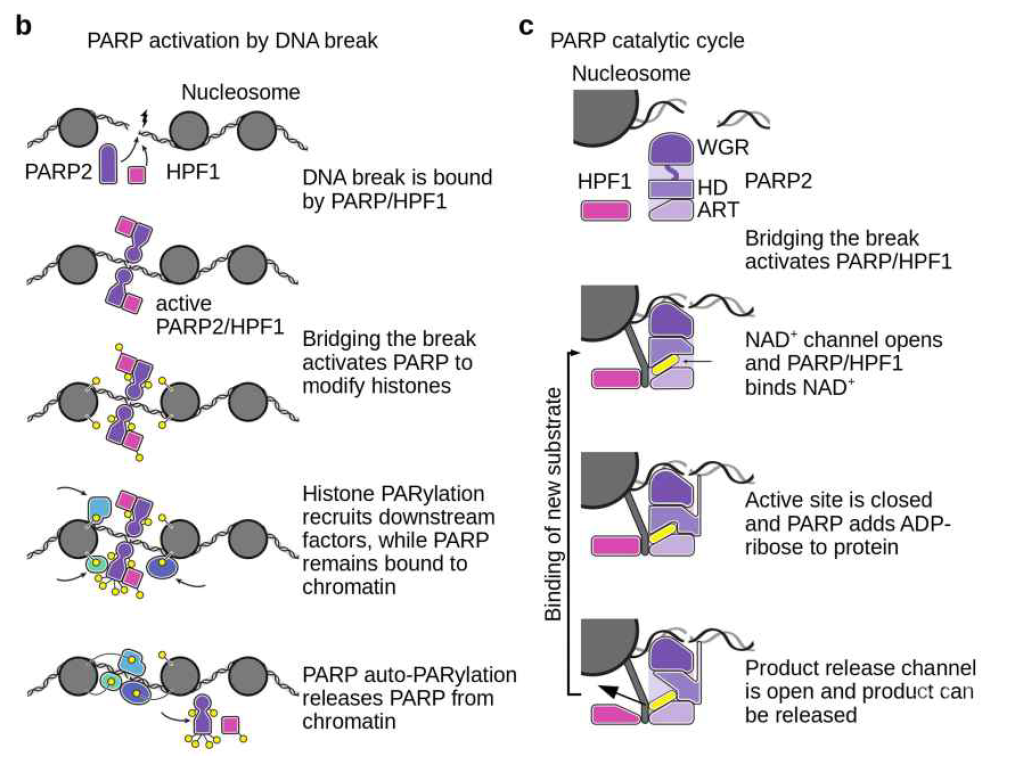
PARP抑制剂已通过美国FDA的审批作为临床抗癌药物,并在BRCA突变的乳腺癌、卵巢癌,以及胰腺癌等治疗中取得了巨大成功,但其耐药性问题也被日益关注,产生耐药性的患者PARP突变也被发现。该项研究为DNA损伤诱导的PARP的激活和PARylation发生机制研究提拱了结构生物学,生物化学上的数据和模型,可以帮助理解临床癌症治疗中病人PARP突变引起对PARP抑制剂产生耐药的原理,阐明这一问题将有助于开发更好的PARP抑制剂以用于癌症治疗。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652499675&idx=3&sn=4823555ae37ccd35b11adda4ac294089&chksm=84e27d6fb395f479608c5c82e072a3e9bbf130eee11b7a8513edd37cb36213daa74fc7838dbb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
DNA-PK激活STING非依赖的DNA识别通路
DNA修复之谜
古DNA研究概览
【科学普及】卵巢癌治疗取得新突破,PARP抑制剂何以立功?

科学家探索物种间DNA组成多样性背后的奥秘

Science:科学家揭示癌症PARP-1抑制剂的变构基础
树枝状DNA组装DNA功能材料的研究进展

DNA机器人一小步 癌症治疗一大步

Nature:DNA错配如何影响蛋白质-DNA结合?
PARP抑制剂为卵巢癌治疗带来希望