科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-11
来源:X一MOL资讯
副标题:大位阻抗衡阳离子辅助的离子对策略在芳烃对位C-H键硼化反应中的应用
过渡金属催化芳烃C-H键的硼化反应已经取得了巨大的发展,此前大多数都是邻位选择性相关的硼化反应,但在过去的十年中,间位选择性反应已经取得了许多成果。铱催化的硼化反应已成为现代芳烃官能团化方法中应用最广泛的方法之一,但是目前只有三例Ir催化的C-H键对位硼化反应报道。Saito、Segawa和Itami等人通过使用一种大位阻的手性膦配体在Ir上创造了一个高度拥挤的环境,但是这种高对位选择性仅限于具有大位阻取代基的底物。Nakao等人使用了一种大位阻路易斯酸催化剂来合成复杂的芳香酰胺,这种催化剂既能活化底物,因位阻相互作用又能促使硼化反应发生在对位。最近,Chattopadhyay等人报道了一种L型双吡啶配体,该配体的钾盐与底物中的酯相互作用,可以直接在对位发生硼化反应。
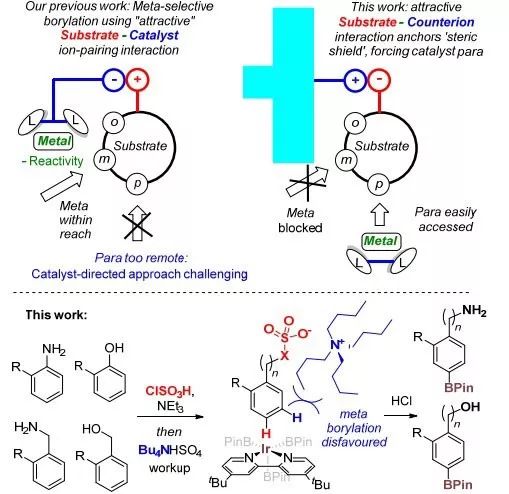
图1. 芳烃对位选择性C-H键硼化反应。图片来源:J. Am. Chem. Soc.
尽管这些方法已经实现了芳烃对位的C-H键硼化反应,但是它们底物适用范围窄,并且需要特定的配体或催化剂,这严格限制了这些方法的进一步使用。过渡金属催化的芳烃对位C-H键硼化仍然是一个非常具有挑战性的课题。最近,剑桥大学Robert J Phipps课题组报道了常见芳烃(苯胺、苄胺、酚、苄醇)对位选择性硼化反应的通用策略,其中使用了硼化反应中常用的催化剂和配体。该策略将底物简单地转化为硫酸盐或磺酸盐,其阳离子部分为四丁基铵,利用阳离子的大位阻效应阻止了底物的间位C-H键硼化,从而实现了具有挑战性的对位选择性硼化。该文章发表于J. Am. Chem. Soc.。
作者首先将2-氯苯胺1a用氯磺酸处理,然后用Bu4NHSO4进行阳离子交换,转化为相应的四丁基氨基磺酸盐2a(图2a)。2a在催化剂[Ir(COD)OMe]2和配体dtbpy作用下,以B2Pin2作为硼化试剂,最终得到了>20:1的对位选择性,粗产物经盐酸甲醇溶液进行简单地处理,就得到了苯胺,其中对硼化苯胺3a的产率为85%。2-三氟甲基苯胺2b也得到了类似的结果,3b收率为84%(图2a)。作为对比,当使用苯胺1a和1b直接进行硼化反应时,m:p比例分别为1:3.9和1:1(图2b);当使用结构和电子性质接近2a和2b的底物4a和4b进行硼化反应时,最终给出的选择性也都很差(图2c)。这一结果表明,氨基磺酸盐2a和2b获得高对位选择性的原因与电子效应无关,与四丁基铵阳离子有重要关系。
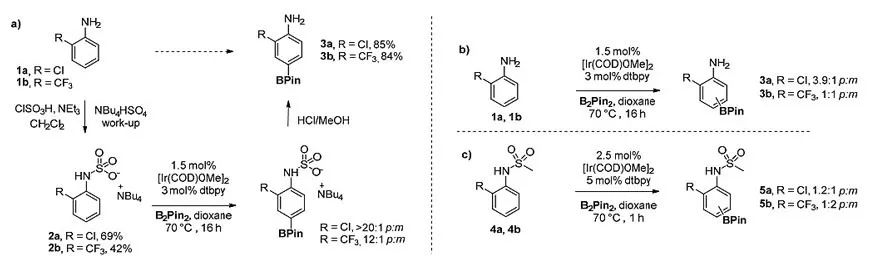
图2. 控制实验。图片来源:J. Am. Chem. Soc.
有了这些初步的结果,作者接下来考察了2-取代苯胺范围。溴和碘取代的苯胺均给出了较高的对位选择性,两者均>20:1(3c, 3d),值得注意的是,在其它C-H键活化方法中,碘取代基通常是不兼容的。2-氰基苯胺的对位选择性略有降低(3f),这与氰基电子效应的是一致,在硼化反应中具有较小的对位定位特点。含有供电子取代基(异丙基、甲氧基)的底物转化率较低,但对位选择性较好。
考虑到苄基胺的普遍存在,作者接下来考察了苄胺衍生的磺胺类化合物。与苯胺衍生物一样,这些苄胺的四丁基铵盐很容易由廉价材料合成。在大多数情况下,这类底物也都能给出>20:1对位选择性(图3B),底物对卤素(包括Cl、Br、I和F)、三氟甲基、三氟甲氧基和二氟甲氧基均兼容。邻位甲氧基取代的底物具有良好的选择性,但转化率较差。
随后,作者对苯酚和苄基醇类底物也进行了考察。许多邻取代苯酚衍生的硫酸盐,包括Cl、Br、I、CF3、OCF3、i-Pr和二氟取代的苯酚,均具有较高的对位选择性(图3C)。与之相对照的是,2-氯苯酚和2-氯苯酚硫酸酯的硼化反应选择性却较差。与苯胺类化合物相比,苯酚类硼化反应对位选择性有所降低。
苄基醇与苯酚类底物类似,它们也对卤素等官能团表现出良好的兼容性(图3D),但是硝基(11h)对位选择性差(4:1),而甲氧基(11f)对位选择性就较好(20:1)。这些结果表明,在底物中,当阳离子的对位定位作用较弱时,取代基的电子效应对选择性的影响就较大。
为了进一步增强该策略的通用性和实用性,作者选择了芳基磺酸盐和苄基磺酸盐(图3E)。与假设一致,这两种底物均能发生对位选择性硼化反应。芳基磺酸盐以及Br、CF3和OCF3取代的芳基磺酸盐都具有良好的对位选择性,取代的苄基磺酸盐也具有非常好的对位选择性。
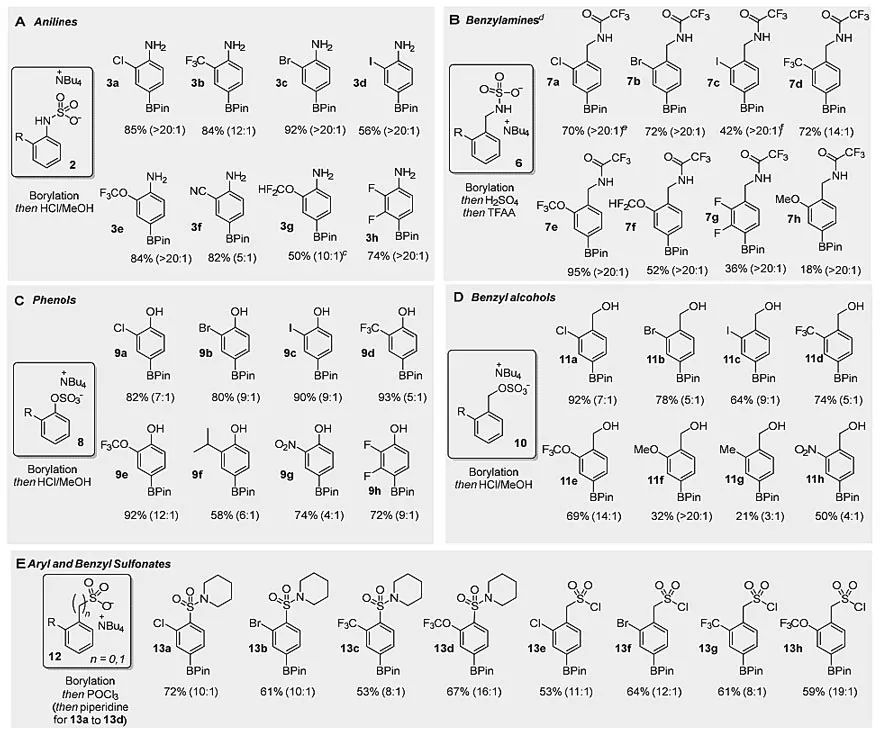
图3. 底物范围考察。图片来源:J. Am. Chem. Soc.
在最开始,作者就提出了一个假设,即大位阻的四丁基胺类阳离子可能在芳烃周围占据足够的空间,使间位的硼化反应变得不占优。为了证明这一假设,他们选择了2-氯苄基磺酸盐作为底物,对阳离子大小的顺序进行了完整的评价。这些实验表明,随着阳离子的增大,对位选择性明显增加(图4b)。
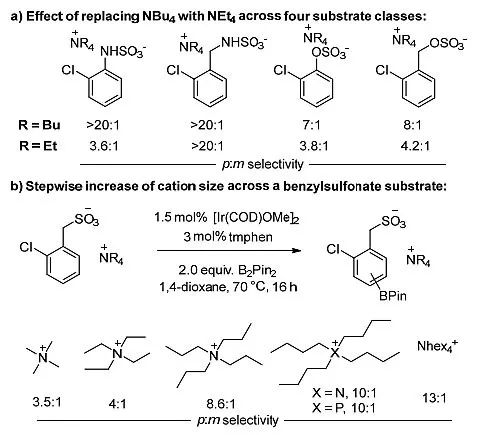
图4. 阳离子对选择性的影响。图片来源:J. Am. Chem. Soc.
最后,作者通过三个底物的X-射线晶体结构给人以直观的印象(图5)。由阳离子提供的大位阻基团作为一种非共价键“防护罩”屏蔽了芳烃间位反应位点。有人会问,如果去除底物中邻位取代基,会降低对位的选择性么?因为两个间位都可能发生硼化反应,而阳离子在任何时候都不能同时阻止两个位置。确实如此,对于所有未取代基底物均显示出非常差的对位选择性。当上述三种底物中延长链长,即芳烃和阴离子基团之间有两个亚甲基时,对位与间位的选择性降低到3:1左右,这可能是与更高的柔性有关。
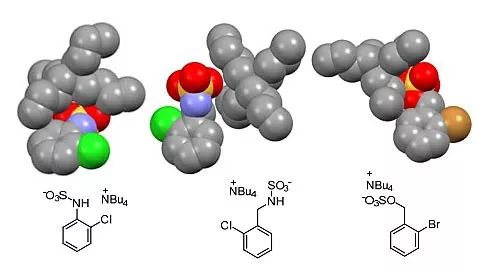
图5. 底物的X-射线晶体结构。图片来源:J. Am. Chem. Soc.
总结
Robert J Phipps课题组开发了一种对位选择性C-H键硼化反应的通用方法,该方法适用于包括苯胺、苄胺、苯酚和苄醇在内的多种常见芳烃,以及芳基磺酸盐和苄基磺酸盐。他们提供的证据表明,这种选择性是由于一个大位阻的四丁基铵阳离子与底物阴离子结合,体积庞大的阳离子阻碍了间位的反应,促进了最具挑战性的对位硼化反应。该方法为对位选择性C-H键硼化反应提供了一个实用和通用的解决方案,并为离子对在催化中的运用提供了一种新的策略。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657619197&idx=2&sn=e81cac678db3e73da90ac24593aa93a4&chksm=80f8252db78fac3be0f82a78ffabb4cdc6a433f7a9bc25e71da995fad1f306ae1cd1dc71c0c9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
动物学: 侦察蚁能够引导搬运食物的同窝蚂蚁回家

2017年“湖南十大科技新闻”揭晓

中国科技新闻学会倡议书

2020年国内十大科技新闻
动物学: 加拉帕格斯群岛的鸟儿喜欢吃花
神经科学:协同工作的大脑

中国科技新闻学会祝您元旦快乐!

【纵览】一周科技新闻
2018年国内十大科技新闻解读

2018国内重磅科技新闻盘点