科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-18
来源:BioArt
原标题:Immunity:孙杰团队揭示组织驻留与肿瘤浸润CD8+ T细胞转录调控机制,为肿瘤免疫治疗提供新思路
记忆性CD8+ T细胞在抗病毒感染免疫以及肿瘤免疫监视过程中发挥着重要作用,其中组织驻留记忆性CD8+ T细胞(tissue resident memory CD8+ T (Trm) cells)是一类近期发现的CD8+ 记忆T细胞亚型,该群细胞在经历感染后主要定植于非淋巴组织中,能够在感染部位对于再次感染快速响应并产生保护【1】。据报道具有Trm 特征的肿瘤浸润CD8+ T 细胞(CD8+ tumor infiltrating lymphocytes (TILs))数量与肿瘤患者预后有明显的正相关性,并且 Trm细胞可以有效控制在动物模型中实体肿瘤的生长【2】。尽管有报道显示Trm细胞与TIL细胞表达相似的组织驻留相关基因【3】,然而目前对于其非淋巴器官环境内的转录因子调控、表观遗传学调控以及代谢调控过程以及机制并不十分清楚, 阐明这一系列机制对于抗病毒免疫以及实体肿瘤免疫治疗都将具有重要意义。
2019年9月17日,梅奥诊所(Mayo Clinic)的孙杰博士团队在Immunity 期刊上发表了题为The transcription factor Bhlhe40 programs mitochondrial regulation of resident CD8+ T cell fitness and functionality 的论文(第一作者为李超凡博士),阐明了在转录因子Bhlhe40调控下的一系列表观遗传修饰与代谢过程对于Trm与TIL细胞发挥功能和免疫检查点阻断治疗响应性有重要作用,并根据这一机制,通过体外筛选获得了一组促进肿瘤浸润CD8+ T细胞组织驻留功能从而有效抑制实体肿瘤生长的小分子化合物,有望对肿瘤免疫治疗起到有效促进。

首先通过对肿瘤病人临床样本以及小鼠CD8+ T细胞分析,研究者发现相较于循环或免疫器官中的CD8+ T细胞,Trm与TIL细胞均高表达转录因子Bhlhe40及其相关基因簇, 这一结果通过对张泽民教授团队发表的肿瘤病人单细胞测序数据【4】分析得到了进一步验证。
对于Bhlhe40缺失小鼠进行病毒感染以及肿瘤接种,研究者发现在流感病毒感染过程中,Bhlhe40缺失并不影响效应性CD8+ T细胞与脾脏记忆性CD8+ T细胞的功能,却特异性地降低了肺中的Trm细胞数量,从而使得Bhlhe40缺失小鼠在二次流感感染中难以得到由Trm细胞介导的有效保护。而在皮下接种肿瘤实验中, 作者发现Bhlhe40缺失CD8+ T细胞在肿瘤生长后期显示出了较差的抗肿瘤能力,从而难以有效抑制肿瘤生长。通过对于Bhlhe40上游信号分析,作者发现PD-1-PD-L1信号通路显著抑制Bhlhe40表达, 并且Bhlhe40缺失的荷瘤小鼠对于PD-L1抗体治疗并不响应 (图1),这也预示Bhlhe40在TIL细胞中的表达水平有潜力成为免疫检查点阻断治疗效果的预测指标。
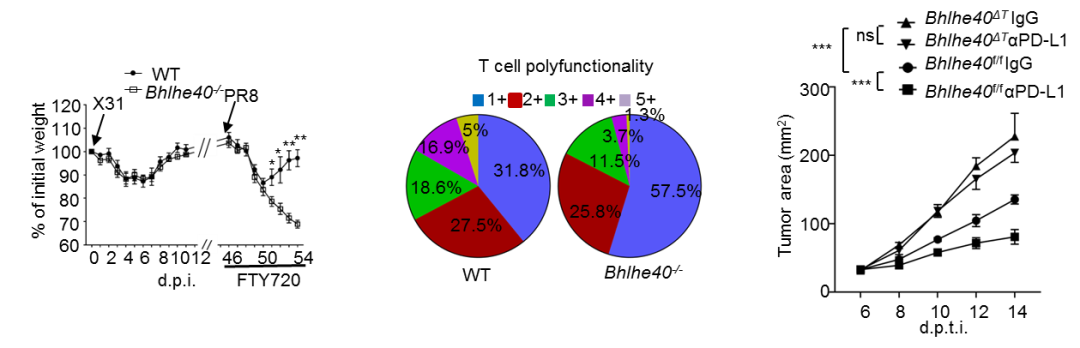
图1
作者进一步对Bhlhe40的作用机制进行了研究,通过RNA-seq以及代谢组学分析, 作者发现Bhlhe40作为转录因子,可以结合在一系列线粒体相关基因启动子上,从而调控线粒体氧化呼吸功能;Bhlhe40缺失CD8+ T细胞下调了包括三羧酸循环等线粒体代谢途径,从而使得代谢中间产物乙酰辅酶A (Ace-CoA) 产生受阻。Ace-CoA除作为代谢中间产物完成细胞能量代谢外,仍具有重要的的调控作用, 是表观遗传调控中组蛋白乙酰化修饰(基因转录活化的前提条件)的重要底物,因此Bhlhe40缺失CD8+ T细胞中细胞因子与效应分子基因转录均因此受到了影响,从而导致了Trm与TIL细胞的功能损伤。为了弥补由于Bhlhe40缺失引起的Trm与TIL细胞功能损伤,作者通过体外实验筛选表观遗传调控化合物库,发现组蛋白去乙酰化酶(HDAC)抑制剂Tubastatin-A 与乙酸钠(组蛋白乙酰化另一重要底物)联合使用(TA/AC)可以有效促进Bhlhe40缺失CD8+ T细胞效应功能与组织驻留能力,并能够提升正常CD8+ T细胞的这一系列能力。
肿瘤中TIL细胞耗竭与失能的重要原因即是固化的抑制性表观遗传修饰【5】,因此能否扭转表观遗传固化将决定肿瘤免疫治疗效果。体内实验中,作者发现无论在细胞过继治疗模型还是肿瘤原位治疗模型中,Tubastatin-A 与乙酸钠联合使用均能够显著提高荷瘤小鼠中TIL 细胞的整体组蛋白乙酰化程度,以及特定效应分子部位组蛋白乙酰化水平,从而提高TIL细胞的抗肿瘤能力与组织驻留能力,最终显著延长了小鼠存活时间(图2)。
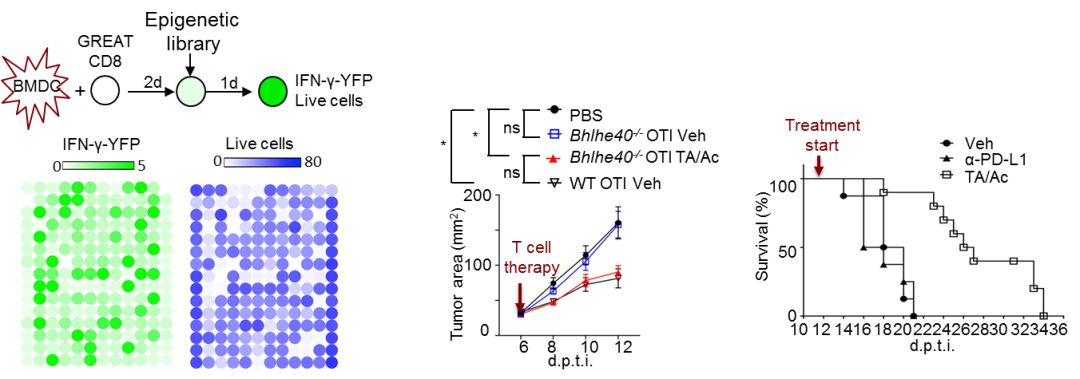
图2
总之,该项研究表明非淋巴组织与肿瘤中驻留的CD8+ T细胞通过上调转录因子Bhlhe40的表达水平来维持自身的代谢与表观遗传修饰, 从而有效响应再次感染以及肿瘤免疫检查点治疗;并且通过这一机制,为日后肿瘤免疫治疗效果预测以及药物筛选提供了新思路(图3)。
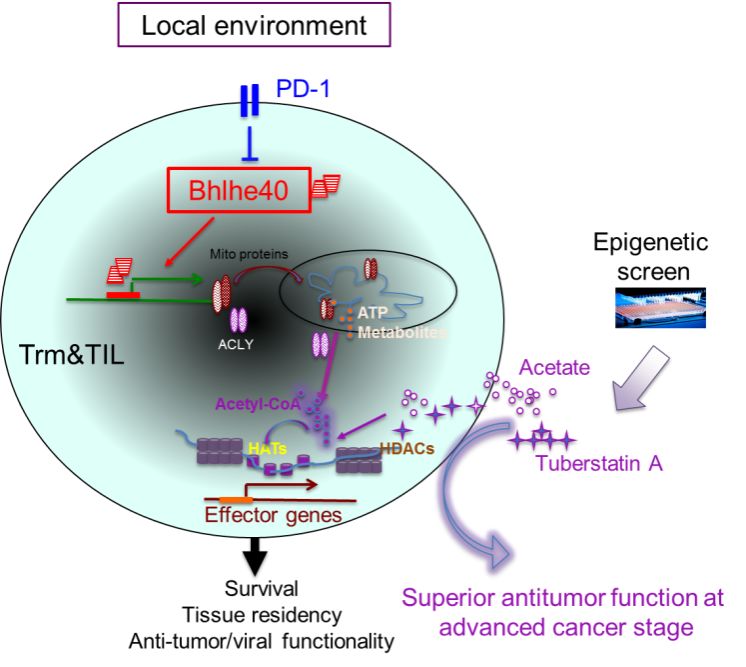
图3
原文链接:
https://doi.org/10.1016/j.immuni.2019.08.013
参考文献
1. Gebhardt, T. et al. Memory T cells in nonlymphoid tissue that provide enhanced local immunity during infection with herpes simplex virus. Nat Immunol 10, 524-530, doi:10.1038/ni.1718 (2009).
2. Savas, P. et al. Single-cell profiling of breast cancer T cells reveals a tissue-resident memory subset associated with improved prognosis. Nat Med 24, 986-993, doi:10.1038/s41591-018-0078-7 (2018).
3. Milner, J. J. et al. Runx3 programs CD8(+) T cell residency in non-lymphoid tissues and tumours. Nature 552, 253-257, doi:10.1038/nature24993 (2017).
4. Zhang, L. et al. Lineage tracking reveals dynamic relationships of T cells in colorectal cancer. Nature 564, 268-272, doi:10.1038/s41586-018-0694-x (2018).
5. Philip, M. et al. Chromatin states define tumour-specific T cell dysfunction and reprogramming. Nature 545, 452-456, doi:10.1038/nature22367 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475381&idx=2&sn=f1965bc47ac70284df67509be6d1e65c&chksm=84e21c41b39595579cea4c062ab33ee60974ad4028df2db999b9f0d38af5772ad43803933321&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn