科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-24
来源:BioArt
原标题:NBT: 陈斯迪组建立新型AAV转座子CRISPR筛选技术并在CD8 T细胞上筛选出胶质母细胞瘤免疫治疗新靶点
近年来,肿瘤免疫疗法给无数的肿瘤患者带来了希望。免疫检查点疗法是当前肿瘤免疫治疗的核心,PD-1或是其配体PD-L1以及CTLA4抗体在部分肿瘤治疗过程中表现非常优越。这也逐渐让免疫检查点疗法成为临床一线标准疗法。由此可见,免疫检查点疗法的重要性不言而喻,这也让该领域的开创者James Allison 和 Tasuku Honjo 赢得了2018年诺贝尔生理医学奖。然而,对于患有胶质母细胞瘤(Glioblastoma, GBM)的患者而言,免疫检查点疗法的作用微乎其微。这也许跟胶质母细胞瘤以及大脑环境的特殊性密切相关。
胶质母细胞瘤是一种非常常见并且致死率最高的一类脑瘤,患者的生存期一般不超过15个月。目前主要的治疗手段是手术,化疗和放疗,但这些都只能短期内产生部分疗效,且具有较强的毒副作用【1】。在过去的25年里,胶质母细胞瘤的治疗并没有突破性的进展,除了替莫唑胺药物化疗结合放疗可以稍微延长患者的生存时间。目前为止还没有免疫治疗相关的药物可用于胶质母细胞瘤的治疗。除了免疫检查点治疗外,嵌合抗原受体T细胞(CAR-T)是另一类非常有希望攻克肿瘤的治疗手段,其原理主要是通过改造T细胞的基因使其可以更加特异的识别肿瘤抗原,并高效的将肿瘤细胞杀死。这类系统已经在血液瘤治疗中得到了充分的证明,美国FDA已经批准了多款CAR-T治疗方案用于血液瘤的临床治疗。CAR-T治疗在实体瘤中仍然面临诸多困难,胶质母细胞瘤又是实体瘤中难治的代表之一。总而言之,目前尚没有很好的免疫检查点和CAR-T治疗手段可以用于临床的胶质母细胞瘤的治疗。因此,寻找和开发更加高效的实体瘤免疫治疗手段是当前的研究热点,同时也是该领域的难点。
2019年9月23日,来自美国耶鲁大学医学院的陈斯迪(Sidi Chen)团队在Nature Biotechnology上发表题为In vivo CRISPR screening in CD8 T cells with AAV–Sleeping Beauty hybrid vectors identifies membrane targets for improving immunotherapy for glioblastoma 的一项研究。作者从胶质母细胞瘤模型入手,通过CRISPR筛选技术并结合腺相关病毒(Adeno-associated virus,AAV)和“睡美人”(Sleeping Beauty)转座子系统筛选得到了多个新型的肿瘤免疫治疗新靶点。该项目第一作者是叶露鹏博士和MD/PhD学生Jonathan Park(朴俊英)和Matthew Dong(曾家宝) 。值得一提的是,这是该团队继上个月在Cell上发表的第二篇关于CRISPR筛选用于肿瘤免疫治疗新靶点发现的文章,Matthew Dong和叶露鹏博士同样是Cell文章的第一作者 (详见BioArt报道:Cell | 陈斯迪组首次在CD8 T 细胞中实现体内全基因组CRISPR 筛选并发现全新的免疫治疗新靶点)。

作者首先构建了一个膜蛋白相关的基因敲除文库,希望通过CRISPR 筛选技术找出全新的免疫治疗新靶点。高效的基因编辑鼠源CD8 T 细胞一直是该领域的难点,常规的细胞转染和慢病毒递送方法都无法实现高效的基因打靶。在本研究中,作者发现用腺相关病毒(AAV)递送sgRNA可以很好的实现基因打靶。然而,AAV是一类非整合的病毒,随着细胞的增殖,AAV 会慢慢的丢失。为了能让AAV递送的DNA元件可以整合到细胞的基因组,研究人员在AAV 载体上装了一个超高活性的“睡美人”转座子,这样可以利用转座子系统将包裹在AAV 中的DNA元件整合到基因组中,这在后续的筛选实验中非常重要。研究人员将膜蛋白相关的基因打靶文库克隆到AAV-SB-CRISPR 在体中,然后包装成AAV病毒之后感染CD8 T 细胞,最后将T 细胞通过尾静脉注射到患有GBM的小鼠体内。筛选结果显示Pdia3,Mgat5,Emp1,Lag3,Pde5a,Ccdc80,Defb26等多个基因得到了高度的富集。值得一提的是,研究人员做了三次独立的在体筛选,发现Pdia3,Mgat5和Emp1惊人的富集在三次的筛选中。
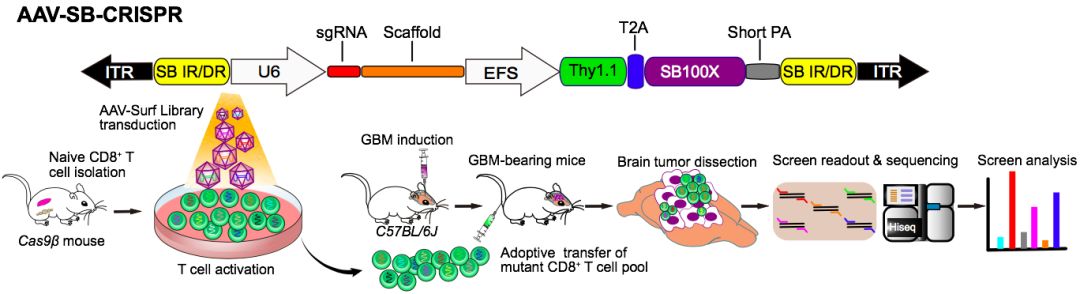
为此,在后续的验证实验中研究人员重点对Pdia3, Mgat5和Emp1这三个基因进行了验证,尤其是Pdia3,在免疫治疗领域从来没有被报道过。在抗原和CD8 T 细胞特异识别的实验中,作者发现Pdia3, Mgat5或Emp1敲除的CD8 T 细胞可以增强T细胞的抗肿瘤活性,延长了小鼠的生存时间。与对照组相比,肿瘤浸润T细胞的比例也有了显著地提高。研究人员还尝试了颅内直接注射Pdia3或Mgat5敲除的CD8 T 细胞,发现同样可以延长小鼠的生存时间。跟进实验结果显示 Pdia3敲除后显著地提高了促炎症相关基因的表达, 结果显示T 细胞激活信号通路(T cell signaling pathway)变得更加灵敏,只需低浓度的CD3刺激便可快速的激活T细胞. 研究人员尝试了三阴乳腺癌模型,发现T细胞Pdia3敲除也可以明显的限制肿瘤的生长. 作者同样在人CD8 T 细胞中进行了验证。研究人员首先建立了PDIA3敲除的人CD8 T细胞,发下PDIA3敲除之后同样提高了 T 细胞功能和一些共刺激因子的表达。最后作者构建了胶质母细胞瘤的CAR-T 细胞,在体外杀伤实验中,PDIA3敲除的EGFRvIII CAR-T细胞具有更强的肿瘤杀伤能力。
总之,本研究对传统CRIPSR筛选技术进行了优化,将CRISPR筛选系统与AAV和转座子结合起来,提供了一个全新且高效的CRIPSR筛选方法。作者利用该方法对膜蛋白进行了筛选,最终得到了多个全新的肿瘤治疗新靶点,为今后抗肿瘤免疫治疗提供了新思路和新手段。
原文链接:
https://www.nature.com/articles/s41587-019-0246-4
参考文献
1. Imperato, J. P., Paleologos, N. A. & Vick, N. A. Effects of treatment on long-term survivors with malignant astrocytomas. Ann Neurol 28, 818-822, doi:10.1002/ana.410280614 (1990).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475653&idx=4&sn=c347b3b1e9d1beb9d3dd01c5fd9a4aa5&chksm=84e202b1b3958ba79d14f7b79d833afeef7d067809e84f005f74e8ae16ed8be2b0a318f87cb0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn