科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-20
来源:BioArt
肺癌是人类的首要致死性癌症,肺癌的异质性和适应性使肺癌的治疗变得尤其困难。目前临床上对于有明确驱动基因突变的肿瘤患者往往会优先采用靶向疗法,靶向疗法对于实体瘤尤其转移性的实体瘤的治疗效果十分明显。但肿瘤对靶向疗法的响应并非是全面性的,在获得耐药性之后,肿瘤往往会二次生长。Bulk组学结果显示,靶向疗法后二次生长的肿瘤倾向于表现出更强的异质性,这表明肿瘤细胞具有适当的遗传框架和进化手段来发展抗药性。然而Bulk组学的批量抽样分析对深入理解异质性的来源、检测其内在的特性、探究肺癌进展、治疗、复发过程中癌细胞的动态变化过程帮助有限。
近日,UCSF医学院的Collin M.Blakely, Trever G. Bivona教授与陈·扎克伯格生物中心的Spyros Darmanis合作在Cell 上联合发表了文章Therapy-Induced Evolution of Human Lung Cancer Revealed by Single-Cell RNA Sequencing,利用单细胞RNA-seq测序对肺腺癌患者靶向治疗过程进行了追踪,对肺腺癌的发生发展过程进行了单细胞层面的描述,为靶向治疗和免疫疗法提供了新的思路。

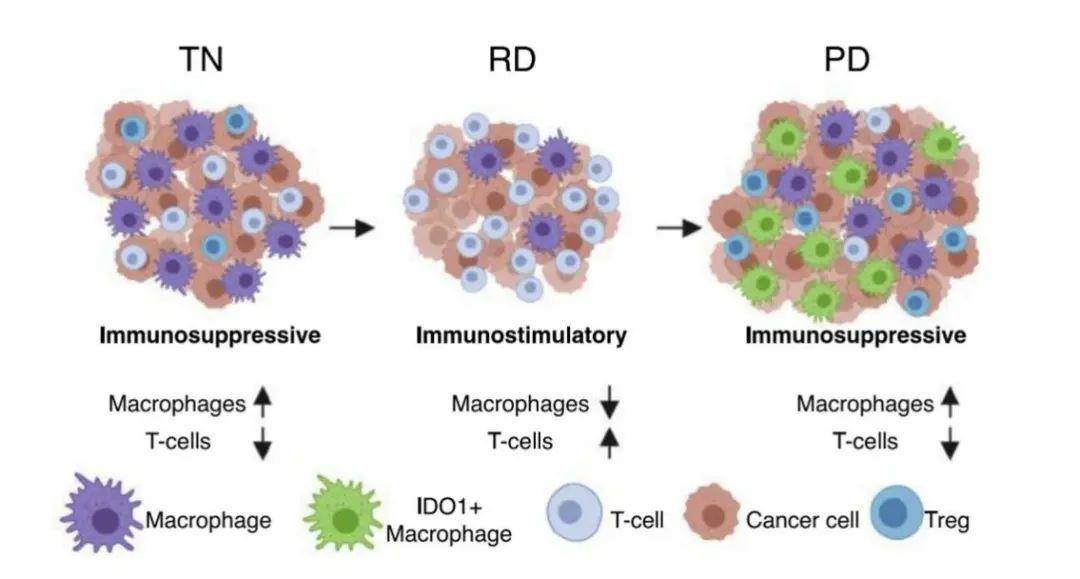
研究者对30名患者在不同治疗阶段(靶向治疗前(TN)、病灶残留阶段(RD)、复发阶段(PD))的病理样本进行了单细胞RNA-seq检测。检测共获得了23261个细胞,根据标记基因的表达水平分为免疫细胞、基质细胞和上皮细胞,根据拷贝数变异程度将上皮细胞进一步区分为癌细胞和非癌细胞。在三例癌旁组织中也有检测到少量肿瘤细胞,由于癌旁细胞处在介于癌细胞和正常细胞两者的中间状态,因此低丰度肿瘤细胞的存在是正常的。总体而言,单细胞RNA-seq结果显示癌症发生的基因特征是由驱动基因(EGFR/ALK/KRAS等)驱动、其他体细胞突变促进的(BAP1/BRCA2等等);在癌症进展过程中突变的驱动基因可能丢失以逃避免疫体系的监控,而较多的体细胞突变往往提示预后不良。
研究者分别对不同治疗阶段的基因表达水平进行了深入对比。与TN阶段相比,RD阶段表现为细胞增殖相关基因表达减低、肺泡细胞特征基因表达升高,提示RD阶段的癌细胞有更强的细胞损伤修复能力、靶向治疗过程中的细胞死亡逃逸能力、及较弱的侵袭性恶性肿瘤特征。具体而言,RD阶段的细胞通过上调CAV1和SUSD2,促进核内beta-连环蛋白(β-catenin)的积累,激活WNT信号通路及其下游靶点,以减弱癌细胞对EGFR抑制剂的响应、促进细胞损伤修复和自我更新、并在靶向治疗期间维持抵抗性癌灶的生成。这一结果提示,在临床靶向疗法过程中,联合使用WNT/β-catenin信号通路抑制剂能够有效提高靶向疗法的响应深度、减少细胞融合事件的发生。
与TN阶段相比,PD阶段表现为犬尿氨酸途径特征基因(IDO1/KYNU/QPRT)表达上调、肿瘤免疫功能下调。TCGA肺腺癌生存分析显示,犬尿氨酸途径特征基因的高表达提示预后不良,指示该途径可能通过诱导肿瘤免疫抑制,影响免疫疗法效果。
对比RD与PD阶段的基因表达谱发现,纤溶酶原激活途径特征基因(ANXA2/PLAT/PLAUR/PLAU/SERPINE1等)在PD中有显著高表达。TCGA肺腺癌生存分析显示,纤溶酶原激活途径特征基因的高表达提示预后不良。既往研究表明,在EGFR抑制剂靶向疗法中,血浆SERPINE1水平上调两倍以上的患者的无进展生存期显著缩短。因此,该组特征基因对靶向疗法抗性及临床转归有指示意义。此外,间隙连接蛋白(GJB2/3/5等)在PD阶段也呈高表达状态,并提示预后较差。
最后,研究者对同一患者在不同治疗阶段的肿瘤免疫微环境的变化进行了分析,结果发现,RD阶段的肿瘤微环境内主要浸润T淋巴细胞(46%),而TN及PD阶段的肿瘤微环境内则主要浸润单核-巨噬细胞。TCGA肺腺癌数据的生存分析显示,肿瘤内巨噬细胞高浸润的患者预后较差,这一结果与接受PD-1抑制剂疗法的黑色素瘤患者的单细胞分析结果相似,后者在治疗过程中出现CD8+T细胞和NK细胞比例上升、M1型巨噬细胞比例下降。
在PD阶段肿瘤微环境中,有一类高表达CXCL9/CXCL10/CXCL11/IDO1的巨噬细胞特异性富集,该类巨噬细胞能够招募髓系来源的抑制性细胞、调节性T细胞和功能缺陷的T细胞来诱导肿瘤微环境产生免疫耐受;而在TN阶段肿瘤微环境中,主要富集的是免疫抑制性M2巨噬细胞。
 总而言之,本研究首次在单细胞转录组层面上对肺癌患者在不同治疗阶段的肿瘤样本进行了横向及纵向对比,对肿瘤内部突变及转录的丰富多样性、动态变化过程进行了阐释;通过对靶向治疗阶段残留癌症病灶的特征和主要生物学途径的探究,解释为何靶向治疗过程中肿瘤细胞的全面响应非常少见,证明了治疗诱导的遗传可塑性是支持靶向治疗过程中肿瘤适应性和进化的基础,并从细胞生态及机制层面为针对驱动基因的靶向治疗及免疫疗法提供了更为详尽的路线图。在EGFR TKI治疗初期,肿瘤微环境内会出现短暂的免疫刺激作用(RD阶段),在此期间引入基于TME靶标的新型联合疗法、以多模式治疗可能会为增加初始反应、巩固抗肿瘤反应提供机会,如以犬尿氨酸途径特征基因IDO1等为靶标,在免疫治疗初期联合使用IDO1抑制剂可以更有效地改变肿瘤微环境内的浸润细胞亚型,使晚期非小细胞肺癌乃至其他实体恶性肿瘤患者产生更为持久的抗肿瘤反应。
总而言之,本研究首次在单细胞转录组层面上对肺癌患者在不同治疗阶段的肿瘤样本进行了横向及纵向对比,对肿瘤内部突变及转录的丰富多样性、动态变化过程进行了阐释;通过对靶向治疗阶段残留癌症病灶的特征和主要生物学途径的探究,解释为何靶向治疗过程中肿瘤细胞的全面响应非常少见,证明了治疗诱导的遗传可塑性是支持靶向治疗过程中肿瘤适应性和进化的基础,并从细胞生态及机制层面为针对驱动基因的靶向治疗及免疫疗法提供了更为详尽的路线图。在EGFR TKI治疗初期,肿瘤微环境内会出现短暂的免疫刺激作用(RD阶段),在此期间引入基于TME靶标的新型联合疗法、以多模式治疗可能会为增加初始反应、巩固抗肿瘤反应提供机会,如以犬尿氨酸途径特征基因IDO1等为靶标,在免疫治疗初期联合使用IDO1抑制剂可以更有效地改变肿瘤微环境内的浸润细胞亚型,使晚期非小细胞肺癌乃至其他实体恶性肿瘤患者产生更为持久的抗肿瘤反应。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652500040&idx=5&sn=64a556454a4990da86f296bd61295637&chksm=84e263fcb395eaea031d6b5cb5727535bef518b9c63eb8ce5f6540ee996833ff1da8704eddae#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中科院等科学家合作研究揭示胰腺癌肿瘤-微环境高度异质性细胞特征

RNA疗法可有效治疗肺癌模型小鼠
多措并举、分类施策,有效降低肺癌死亡率

Cancer Cell :王心伟团队揭示肝癌肿瘤异质性驱动肿瘤微环境重编程的影响

Science Advances│王红霞团队研究揭示乳腺癌循环肿瘤细胞异质性
【紫冬声音】AI护航:无创预测肺癌基因突变
Nat Med:液体和组织活检检测胃肠道肿瘤的获得性耐药和肿瘤异质性
三种新的肺癌遗传生物标志物被发现

Cell: 肿瘤内的异质性才是决定肿瘤免疫反应的关键

樊代明代表:肿瘤防治 重在“整合”