科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-29
来源:BioArt
基因工程小鼠是研究基因功能和疾病机制的利器,然而基因工程小鼠的构建费时费力且价格不菲,限制了其广泛应用。为节约经济和时间成本,研究者尝试电转染或病毒系统为基础的转基因策略,以构建体细胞嵌合体小鼠开展相关研究【1,2】。
电转染或病毒为基础的体细胞转基因技术目前应用广泛,但依然存在不足之处:病毒系统的包装能力有限,易引发免疫反应且需要专业培训;此外电转染和病毒系统介导的转基因的整合位点和整合基因的拷贝数均不可控,常会引发细胞毒性和假阳/阴性,不利于探究真实的生物学机制【3-6】。
以癌症研究为例,目前研究者已经发现成百上千种促癌突变且多为功能获得性突变,要构建相关模型,常需要在表达促癌变异基因的同时敲除抑癌基因,这背后的经济和时间成本让多数实验室望而却步。
2019年9月19日,来自加州大学洛杉矶分校(UCLA)希德斯-西奈医疗中心的Joshua J. Breunig实验室在Cell杂志上发表了题为Rapid Generation of Somatic Mouse Mosaics with Locus-Specific, Stably Integrated Transgenic Elements的论文。
文章以Flp和Cre两种重组酶为基础,设计出一种精准的体细胞转基因技术MADR(Mosaic analysis with dual recombinase-mediated cassette exchange),可在多种品系的小鼠中实现转基因的单拷贝定点整合,以构建组织特异性的小鼠嵌合体开展功能研究。
文章通过构建脑胶质瘤模型证实,MADR技术可同时过表达/敲除多种基因,能很好的模拟患者的基因突变特征谱及肿瘤发病进程,具备开展高通量临床前分析和药物筛选的潜力。

MADR技术在细胞系和动物模型中均可应用,但前提是细胞系和动物模型的特定位点处携带有Flp和Cre两种重组酶的识别位点FRT和loxP。为证实该技术的有效性,文章选用mTmG小鼠模型开展相关研究,如图1所示,该小鼠的Rosa26位点处整合有报告基因,正常情况下,小鼠持续表达膜定位的tdTomato红色荧光蛋白,Cre作用下则会表达EGFP绿色荧光蛋白。
要实现目的基因的精准整合,需要构建如图1所示的供体质粒,该质粒只有整合后才会表达目的基因。在mTmG小鼠模型或其来源的神经干细胞中同时转染供体质粒(携带蓝色荧光基因)和双重组酶Flp和Cre,细胞内会发生重组事件:无Cre表达的细胞为红色,Cre表达的细胞为绿色,而Flp和Cre同时表达发生精准整合的细胞则表达蓝色。MADR技术的精准整合可以有效保证转基因的拷贝数(单拷贝或双拷贝),通过更换供体质粒的目的基因,研究者可实现多基因的精准整合和表达。
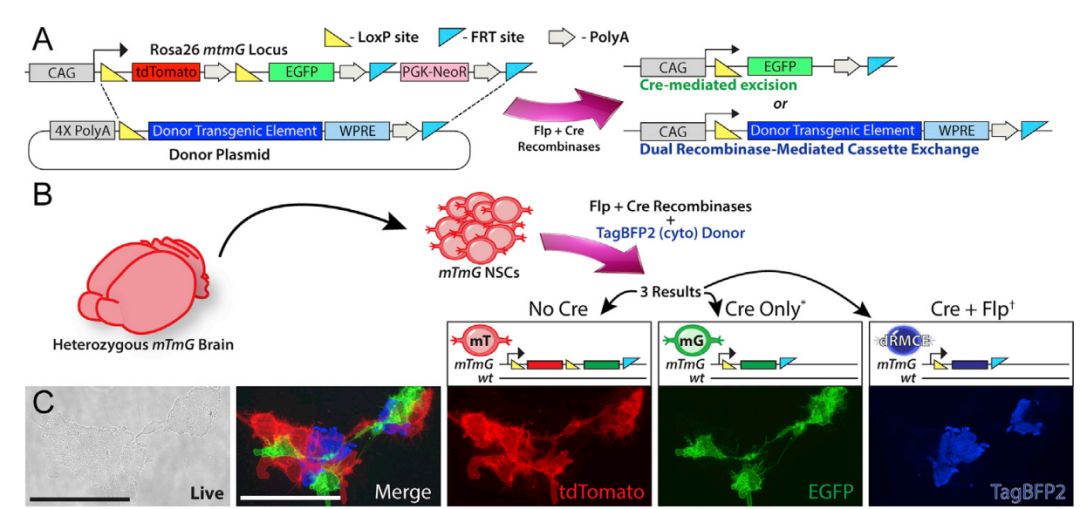
图1 MADR技术的基本原理
证实了MADR技术的可靠性之后,研究者开始尝试用该技术构建脑胶质瘤模型。已知Nf1、Pten和Trp53的缺失型突变是常见的脑胶质瘤驱动因子,为此研究者利用MADR技术在小鼠大脑中同时过表达三种shRNA以同时敲减Nf1、Pten和Trp53,发现此策略有明显促进阳性细胞的过度生长。
此外,研究者还利用MADR技术在小鼠大脑中表达Cas9蛋白及Nf1和Trp53的sgRNA;或过表达Cas9单碱基编辑器及Nf1、Trp53和Pten的sgRNA以研究脑胶质瘤的发病。由此,研究者以MADR为基础,开发出多种工具,可以实现多基因的同时敲除和疾病研究。
普通的转基因模型,如借助于转座子系统的转基因,很难控制基因的拷贝数,这常会干扰生物学机制的研究。比如,小鼠胚胎中PB转座子介导的HrasG12V转基因会在小鼠出生后的15-20天内诱发高恶性肿瘤;然而MADR技术介导的HrasG12V转基因则无此现象。通过MADR技术控制HrasG12V的拷贝数,研究者发现,多数HrasG12V双拷贝的细胞中Rb1会发生磷酸化,而HrasG12V单拷贝的细胞中Rb1的磷酸化现象并不明显;这种差异便难以在PB转座子介导的HrasG12V转基因模型中进行研究。此外,借助于MADR技术,研究者还可以对促肿瘤发生的融合蛋白的功能开展研究,这也是普通的基因工程小鼠难以实现的。
不同患者的同类型肿瘤常会有不同的突变特征谱,以儿童多形性胶质母细胞瘤(GBM)为例,过半数的患者携带有H3F3A突变K27M或G34R,且常伴有Pdgfra(D842V)和Trp53(R270H)突变。虽然有研究者通过基因工程小鼠模型分析过K27M突变的特征,但目前依然缺乏合适的技术对K27M和G34R两种突变的差异进行在体的比较。不过如今借助于MADR技术,研究者分别构建K27M- Pdgfra(D842V)-Trp53(R270H)嵌合体和G34R- Pdgfra(D842V)-Trp53(R270H)嵌合体小鼠以分析两种脑胶质瘤的差异。结果发现,与病人的结果相类似,小鼠模型中K27M相关脑胶质瘤的原发位点与G34R明显不同。
此外,在小鼠大脑中共转染K27M- Pdgfra(D842V)-Trp53(R270H)和G34R- Pdgfra(D842V)-Trp53(R270H)两种供体质粒,研究者可以更准确的比较K27M和G34R对细胞增殖的影响,结果发现K27M突变型细胞的增殖能力明显强于G34R细胞。之后,借助于单细胞转录组和单核ATAC-Seq,研究者更进一步证实,MADR技术为基础构建的K27M- Pdgfra(D842V)-Trp53(R270H)脑胶质瘤模型能很好的模拟人脑胶质瘤的异质性及肿瘤发生的动态特征。
本研究通过开发原位精准转基因技术MADR,实现了转基因的定点整合和精准的拷贝数控制,克服了旧工具的局限性,为体细胞嵌合体模型的快速构建提供了新的策略。以MADR为基础构建的多种脑胶质瘤模型更是让我们见识了该技术的巨大潜力,未来MADR技术的优化及其与其它技术的整合或将为多基因疾病模型的构建及研究带来突破。
原文链接
https://doi.org/10.1016/j.cell.2019.08.013
参考文献
1. Hambardzumyan, D., Parada, L.F., Holland, E.C., and Charest, A. (2011). Genetic modeling of gliomas in mice: new tools to tackle old problems. Glia 59,1155–1168.
2. Breunig, J.J., Levy, R., Antonuk, C.D., Molina, J., Dutra-Clarke, M., Park, H.,Akhtar, A.A., Kim, G.B., Hu, X., Bannykh, S.I., et al. (2015). Ets Factors Regulate Neural Stem Cell Depletion and Gliogenesis in Ras Pathway Glioma. Cell Rep. 12, 258–271.
3. Garrick, D., Fiering, S., Martin, D.I., and Whitelaw, E. (1998). Repeat-induced gene silencing in mammals. Nat. Genet. 18, 56–59.
4. Woods, N.B., Muessig, A., Schmidt, M., Flygare, J., Olsson, K., Salmon, P.,Trono, D., von Kalle, C., and Karlsson, S. (2003). Lentiviral vector transduction of NOD/SCID repopulating cells results in multiple vector integrations per transduced cell: risk of insertional mutagenesis. Blood 101, 1284–1289.
5. Akhtar, W., de Jong, J., Pindyurin, A.V., Pagie, L., Meuleman, W., de Ridder, J.,Berns, A., Wessels, L.F., van Lohuizen, M., and van Steensel, B. (2013). Chromatin position effects assayed by thousands of reporters integrated in parallel. Cell 154, 914–927.
6. Gibson, T.J., Seiler, M., and Veitia, R.A. (2013). The transience of transient overexpression. Nat. Methods 10, 715–721.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475822&idx=1&sn=4e0e6577660831ffd1b0c3322ef15599&chksm=84e2021ab3958b0cd7d8f52dd37ee92dd0aed4f4f6001998caed0109e31c1599003b0524fda6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

一只雌雄嵌合体蜜蜂,会过着怎样的生活?

高彩霞:植物基因剪刀手
人猪嵌合体实验可能培育出聪明的“二师兄”




小鼠—人类胚胎嵌合体含4%人类细胞
院士侯云德



姜韬:对转基因“阴谋论”的技术批评

黄疯蚁创造雄性“嵌合体”揭示迄今未知繁殖模式
科学家用干细胞制出人猪嵌合体胚胎

半雌半雄的嵌合体,其实不那么少见
虾大小的嵌合体节肢动物带来演化新认知 |《自然》论文